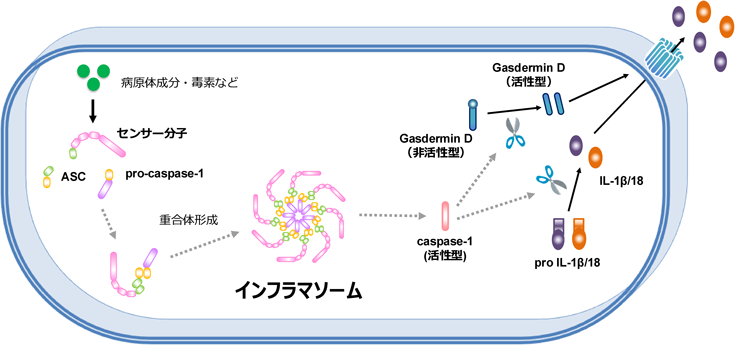
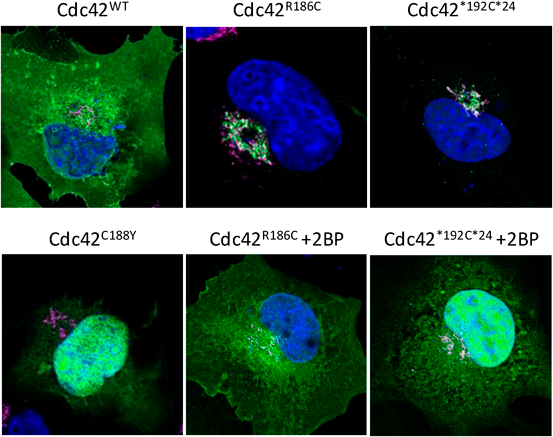
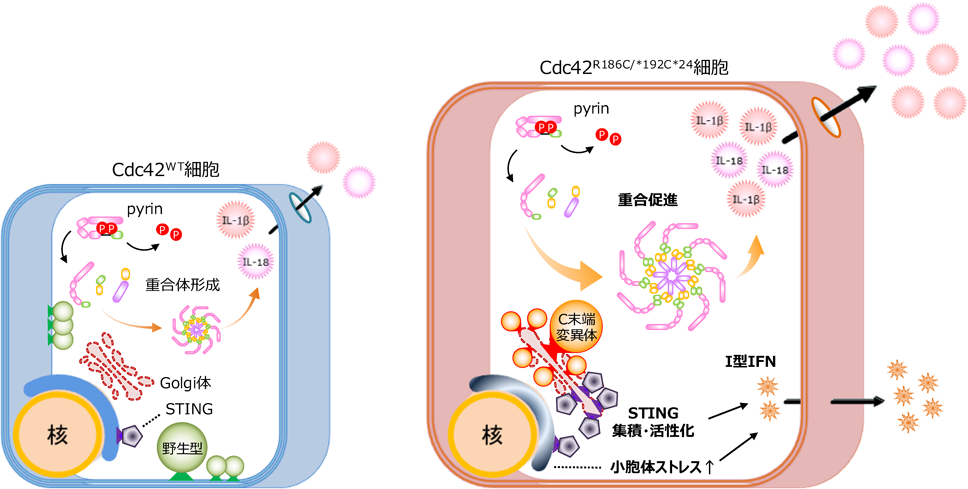
Cdc42 C末端異常症における炎症病態Inflammatory pathology of Cdc42 C-terminal disease
京都大学大学院医学研究科 子どもの健康と環境に関する全国調査(エコチル調査)京都ユニットセンターJapan Environment and Children’s Study Kyoto Regional Center, Kyoto University Graduate School of Medicine ◇ 〒606–8507 京都市左京区聖護院川原町53 分子生物実験研究棟121号室 ◇ Molecular Biology Research Bldg. Rm121, 53 Shogoin-Kawahara-cho, Sakyo-ku, Kyoto 606–8507, Japan