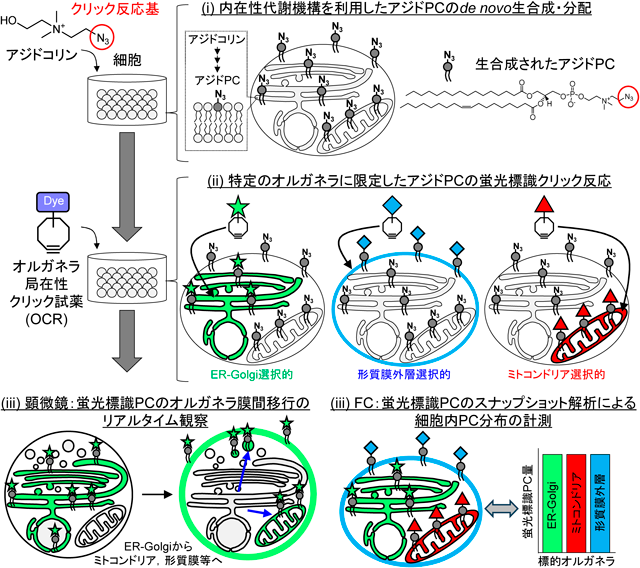
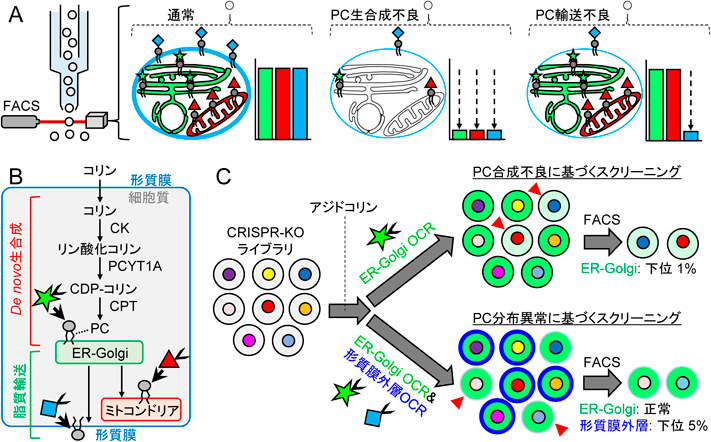
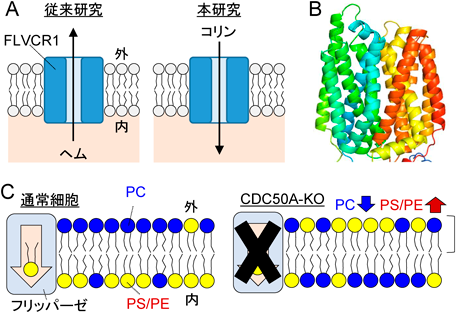
O-ClickFCを用いたホスファチジルコリン代謝動態のCRISPRスクリーニングO-ClickFC allows pooled CRISPR screening of genes involved in phosphatidylcholine metabolism
1 静岡県立大学薬学部School of Pharmaceutical Sciences, University of Shizuoka ◇ 〒422–8526 静岡県静岡市駿河区谷田52–1 ◇ 52–1 Yada, Suruga-ku, Shizuoka 422–8526, Japan
2 京都大学大学院工学研究科合成・生物化学専攻Department of Synthetic Chemistry and Biological Chemistry, Graduate School of Engineering, Kyoto University ◇ 〒615–8510 京都府京都市西京区京都大学桂 A4–331 ◇ Kyoto University, Katsura, Nishikyo-ku, Kyoto 615–8510, Japan
3 JST ERATOERATO (Exploratory Research for Advanced Technology, JST) ◇ 〒102–0075 東京都千代田区三番町 ◇ Sanbancho, Chiyoda-ku, Tokyo 102–0075, Japan