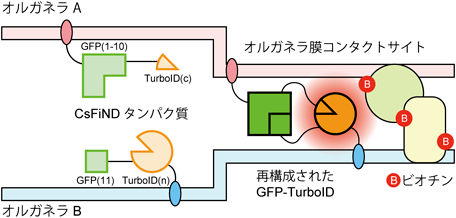
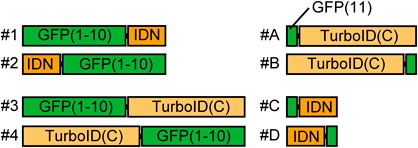
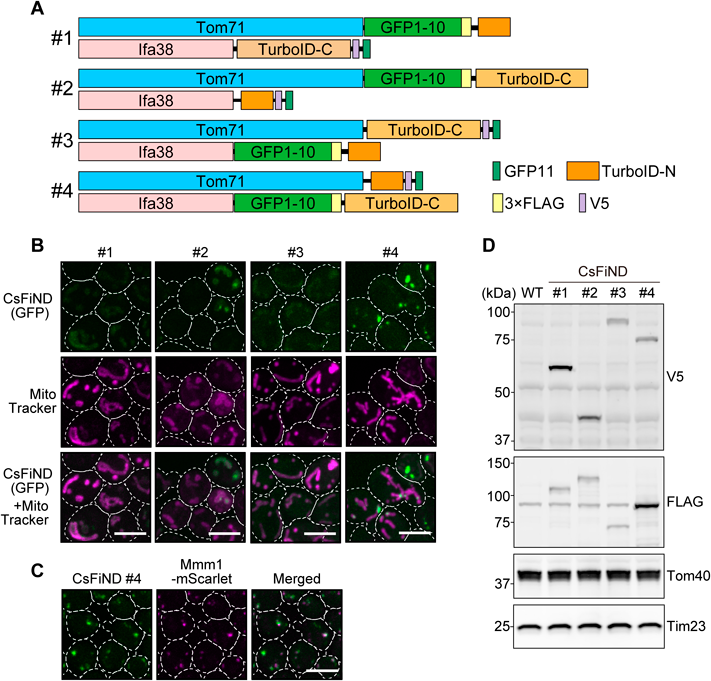
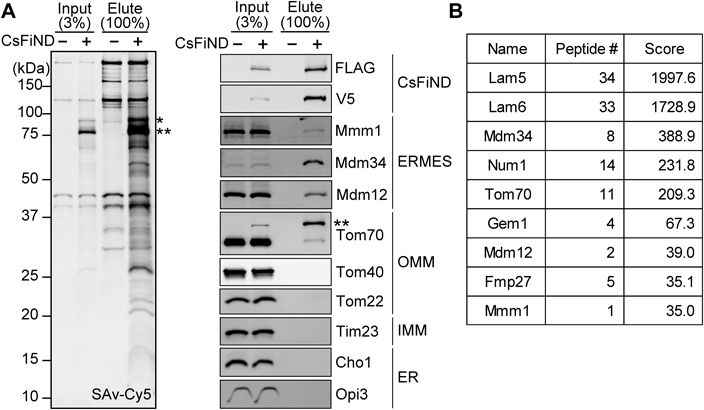
オルガネラコンタクトサイトの新実験ツールCsFiND (Complementation assay using Fusion of split-GFP and TurboID)A novel experimental tool for organelle membrane contact sites: CsFiND (Complementation assay using Fusion of split-GFP and TurboID)
山形大学理学部Yamagata University ◇ 〒990–8560 山形市小白川町1–4–12 ◇ 1–4–12 Kojirakawa-machi, Yamagata, Yamagata 990–8560, Japan