多細胞生物の発生過程では,一つの受精卵が無数の細胞に分裂し,やがて複雑で多様な形態を持つ器官が形成されていく.この過程で,細胞は増殖し,分化し,そして集団として協調しながら移動することで,形態形成が進行する.この動的かつ精巧なプロセスは,生命の神秘と美しさを象徴するものであり,そのメカニズムを解き明かすことは,我々にとって挑戦的かつ魅力的な課題である.
集団細胞移動は,集団内の細胞が相互に影響を及ぼしながら一体となって動く現象であり,発生だけでなく,創傷治癒やがんの浸潤,転移といった病理学的現象にも深く関わる,生命現象において欠かせないプロセスである1–3).この協調的な動きは,単一細胞の移動とは本質的に異なる特徴を持っており,これまでに多くの研究が行われてきた.特に,リーダー細胞とフォロワー細胞の役割に基づく集団移動のメカニズムが注目されてきた4).リーダー細胞は集団の先頭に立ち,ケモカインや成長因子といった誘引因子に反応してアクチン細胞骨格の特徴的なリモデリングなどを経て移動の方向を決定し,その指示に従ってフォロワー細胞が集団全体の動きを調整する.
しかし,近年のライブイメージング技術の進展により,リーダー細胞を持たない新たな集団細胞移動のメカニズムが解明されつつある5).このモデルでは,リーダー細胞が存在せずとも,すべての細胞が対等な立場で協調しながら動く.たとえば,哺乳類の乳管伸長6),ショウジョウバエの卵室の回転7)や雄性外生殖器の回転形成8)などである.このようなリーダー細胞非依存型の移動は,従来の理解を覆し,新たな集団細胞移動のモデルとなっている.
本稿では,主に組織形成過程でみられる,リーダー細胞依存型の集団細胞移動と,リーダー細胞非依存型の移動に焦点を当て,それぞれの例となる発生イベントを挙げながら各現象のメカニズムを詳述する.特に,著者らの研究対象であるショウジョウバエの雄性外生殖器の回転を例として取り上げ,その詳細なメカニズムを解説する.また,これらの移動においてアクトミオシンが果たす役割にも焦点を当て,両集団細胞移動がどのように形態形成や組織再構築に寄与しているのかを紹介していく.
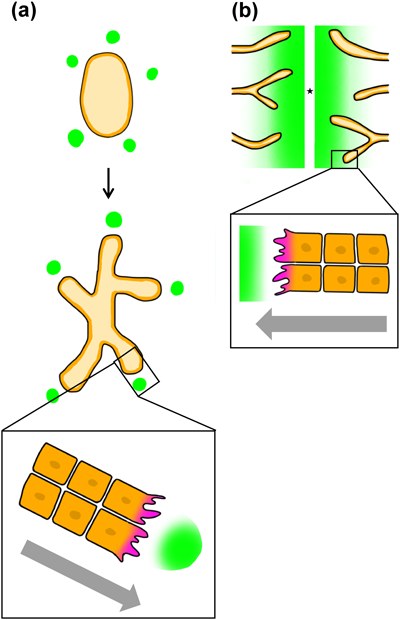
集団細胞運動は,多細胞生物の組織や器官の形成に不可欠なプロセスであり,その秩序だった動きにはリーダー細胞が重要な役割を果たすことが多い.リーダー細胞は集団の先頭に位置し,外部からのシグナルに応答して移動の方向性を決定する(図1a, b).その後,後続のフォロワー細胞がリーダー細胞に従い,集団全体が協調して移動することで,組織形成が正確に進行する.このようなリーダー細胞依存型の集団細胞運動は,さまざまな生物種や発生現象で観察されている.まず,代表的な事例として,リーダー細胞に依存した集団細胞運動の具体的なメカニズムとその例をみていくことにしよう.
1)ショウジョウバエの気管分岐形成
ショウジョウバエの気管分岐形成は,リーダー細胞に依存した集団細胞移動の代表的な例である9–11).この過程ではまず,外胚葉細胞が上皮板から貫入して気管嚢を形成し,その後,気管分岐が開始される9).リーダー細胞は,成長因子Bnl[Branchless,繊維芽細胞成長因子(FGF)のショウジョウバエオルソログ]によって誘導される(図1a).Bnlは,嚢の周囲に存在する五つの小さな表皮細胞クラスターで主に発現され,これらのクラスターに最も近い細胞がリーダー細胞として機能する10).リーダー細胞は,Bnlシグナルに応答して受容体であるBtl(Breathless,ショウジョウバエのFGF受容体)を介して応答し,アクチン重合を促進して細胞骨格を極性化させ,アクチンフィラメントを含む細胞膜の細長い突起構造(糸状仮足)を形成し,周囲の細胞との接着を保ちながらBnlの供給源に向かって移動する12).この移動により,気管の枝分岐が形成される.リーダー細胞とフォロワー細胞は,接着結合を介して物理的に相互作用しながら,リーダー細胞の進む方向に従って移動する.
2)ショウジョウバエ卵室の境界細胞移動
ショウジョウバエの卵室における境界細胞移動も,リーダー細胞に依存した集団細胞運動の代表例である.卵室の境界細胞は濾胞細胞に由来し,発生過程において卵室内の哺育細胞間を移動して,卵母細胞との境界を形成する.リーダー細胞は,卵室内で分泌される成長因子Pvf1やEGFのシグナルを受け取り,移動の方向性を決定する13, 14).リーダー細胞は,アクチン骨格を再編して糸状仮足や葉状仮足などの膜突起を形成し,周囲の細胞と接着したまま,境界細胞群全体が移動する13).Pvf1とEGFの濃度勾配がリーダー細胞の位置決定に重要であり,リーダー細胞がフォロワー細胞を正確に誘導することで,卵室の形態形成が正確に行われる.
3)脊椎動物の血管分岐
脊椎動物の血管新生においても,リーダー細胞依存型の集団細胞運動が観察される.血管新生は,既存の血管から新しい血管が伸びていく過程であり,この際に血管内皮成長因子(vascular endothelial growth factor:VEGF)の必要性が明らかになっている.VEGFは,血管周囲に局在して濃度勾配を形成し,リーダー細胞を誘導するシグナルを提供する.
VEGFには四つのアイソフォームが存在し,その中でもVEGF-Aは細胞外マトリックス(extra cellular matrix: ECM)のひとつであるヘパリンとの結合ドメインを持つ.マウス網膜における血管新生では,アストロサイトによって分泌されるVEGF-Aの拡散が,ECMとの相互作用により制限され,VEGFの局所的な濃度勾配が形成される.この濃度勾配に応答して,リーダー細胞はVEGF受容体を介してシグナルを受け取り,糸状仮足を形成する.この糸状仮足は,VEGFシグナル源に向かって伸び,血管の先端を牽引する(図1b).後続の血管内皮細胞はリーダー細胞に追従し,新しい血管が正確に形成される15).
選択的スプライシングによってヘパリン結合ドメインが欠如するアイソフォーム,VEGF120のみを発現する変異マウスでは,糸状仮足の方向性が失われ,血管分岐に異常が生じる16).このように,VEGFシグナルを局所的に制御することは,リーダー細胞依存型の血管新生における方向性の決定に不可欠である.
4)ゼブラフィッシュの側線細胞移動
ゼブラフィッシュの側線細胞は,水中の流れや振動を感知する感覚器官である側線系を構成する.発生過程では,側線前駆細胞が胚の体幹を移動しながら感覚器官を形成するため,その動態は細胞移動や形態形成研究のモデルとして注目されている.この移動は,CXCL12/SDF-1によって誘導されるもう一つのリーダー細胞依存型の例である17, 18).側線細胞は,水平筋中隔に沿って移動し,正確な経路をたどって目的地に到達する.興味深いことに,このケースではCXCL-12/SDF-1が移動経路全体に均一に発現している一方で19),その受容体であるCxcr4bとCxcr7は側線細胞集団内で前後に極性化している.Cxcr4bは側線細胞の前部で発現しており,CXCL-12/SDF-1に応答して移動シグナルを活性化する.一方で,Cxcr7は側線細胞の後部で発現しており,CXCL-12/SDF-1を細胞内に取り込み,シグナルの勾配を調整する20, 21).この極性化した受容体の働きにより,側線細胞のリーダー細胞は正確な方向性を持って移動し,フォロワー細胞がこれに追従する.このプロセスにより,側線細胞は精密に誘導され,正確な方向に沿って移動が行われる.
以上に取り上げた事例で共通のメカニズムは,リーダー細胞が誘引因子に応答して集団の進行方向を決定し,フォロワー細胞を牽引する役割を担っていることである.また,シグナルの局所的な濃度勾配がリーダー細胞の極性形成と方向性の決定に不可欠な要素となっており,細胞間の接着によって集団全体の秩序だった移動が実現されている.
ここまで述べたリーダー細胞依存型の集団細胞移動の研究は長い歴史があり,その詳細なメカニズムも広く解明されてきた.しかし,近年のライブイメージング技術やオルガノイド培養技術の発展により,リーダー細胞を伴わない集団細胞移動が観察されるようになった.リーダー細胞が存在しない場合でも,細胞集団は協調して動作し,全体として特定の方向に秩序だった移動を行う.こうした移動様式は,発生過程や組織形成の重要な局面で観察される.
1)哺乳類の乳管形成
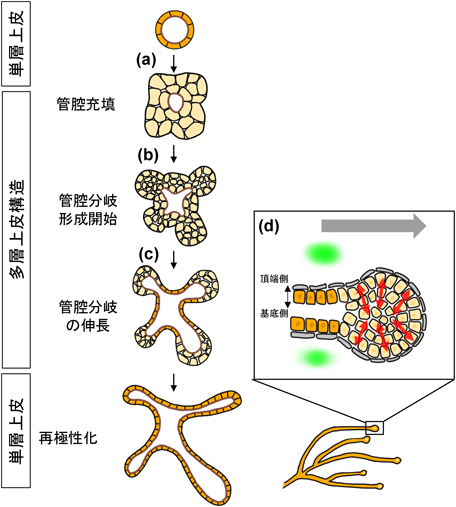
哺乳類の乳管形成は,リーダー細胞に依存しない集団細胞移動の代表例である.乳管形成は,胎生期と思春期の二つの段階で進行する22).胎生期では,乳房上皮が間葉へと貫入し,乳房芽を形成する(図2a).思春期には,ホルモンの影響で乳管の先端が膨張して「終末芽(terminal end bud:TEB)」と呼ばれる多層構造を形成し23)(図2d),このTEBが乳房の脂肪組織を横断して移動することで,乳管の伸長と分岐が進む(図2b, c).この過程におけるTEBの移動様式は,従来のリーダー細胞を伴う細胞移動とは異なっている24, 25).ライブイメージングにより,TEBはECMに突起を伸ばして牽引力を発揮するのではなく,平滑な細胞表面を維持して移動していることが明らかになった26)(図2d).代わりに,TEB内部の細胞がアクチンフィラメントを放射状に配向させ,微細な突起を内部に向かって形成している.これにより,内部細胞は多層上皮内を陥入しながら移動する.この運動は「放射状インターカレーション(陥入)」と呼ばれ,この現象により,多層上皮が外側に広がり,管の構造が形成される27)(図2d).このプロセスにはアクトミオシンによる収縮力が重要であり,Rhoキナーゼ(Rho-associated protein kinase:ROCK)阻害剤であるY-27632の投与により,放射状インターカレーションが阻害されることが確認されている26).乳管形成においては,成長因子やステロイドホルモンが関与しているが28),リーダー細胞不在の集団運動を誘導する決定的な走化性因子はまだ見つかっていない.一方,TGFβが負の調節因子として働くことが示されている.たとえば,TGFβ発現細胞の移植により,マウス乳管の伸長が抑制されることが報告されている29, 30).また,TGFβが高濃度で分布する領域では,乳管の分岐が阻害されることも示されており31)(図2d),TGFβがTEBの集団細胞移動を抑制する役割を果たしている可能性がある.
2)哺乳類の唾液腺や腎細管の分岐形成
唾液腺や腎細管の分岐形成も,リーダー細胞を伴わない集団細胞移動の一例として注目されている.これらの分岐形成過程では,細胞間のシグナル伝達や接着分子を介して細胞全体が統一的に制御され,集団としての秩序だった動きが実現されている.
唾液腺の分岐形成において,リーダー細胞が明確でない集団細胞移動が確認されている.特に,BTB/POZドメインを持つBtbd7[BTB(POZ)domain containing 7]は上皮細胞の動態を制御し,FGFなどの外因性シグナルに応答して唾液腺の分岐形態形成を促進する32).Btbd7は,E-カドヘリンの発現レベルを低下させることで,上皮細胞間接着を弱め,ECMへの接着を強化することで,分岐形成を促進する細胞移動を誘導する32).
また,腎細管の形成も,リーダー細胞が関与しない一例である.尿管芽の分岐形成は,間葉細胞からのGDNF(glial cell line-derived neurotrophic factor)シグナルに依存しており,このシグナルにより上皮細胞は均等に集団で移動し,分岐が進行する.この際,細胞間の接着やシグナル伝達が細胞の動きを制御しており,リーダー細胞が先導することなく,全体としての方向性が決定される33).腎臓の分岐形成における尿管芽の移動には,リーダー細胞が明確には存在しないが,特に興味深いのは,有糸分裂に伴って尿管芽の先端細胞の一部が「分散」する現象である.タイムラプスイメージングにより,分裂後の娘細胞の一方は元の位置に戻るが,もう一方の細胞は異なる位置に移動することが観察された.この現象は「有糸分裂に伴う細胞分散(mitosis-associated cell dispersal)」と記載され,尿管芽の集団移動の際に,先端部分へ細胞を再配置して尿管芽を動かすために重要な役割を果たすと考えられている34).
このように,哺乳類の唾液腺と腎臓の分岐形態形成には,管の先端における集団での細胞再配置や,特殊な動的細胞増殖の関与が示唆されている.どの例も,明確なリーダー細胞が不在であるが,本当にリーダー細胞非依存的なのかどうか,また誘導シグナルによってどの程度,方向性が厳密に制御されているかは不明である.これらのモデルをさらに検討することで,管形成で観察される集団細胞移動に関与するさまざまなメカニズムを明らかにするのに役立つだろう.
3)ショウジョウバエ卵室の回転
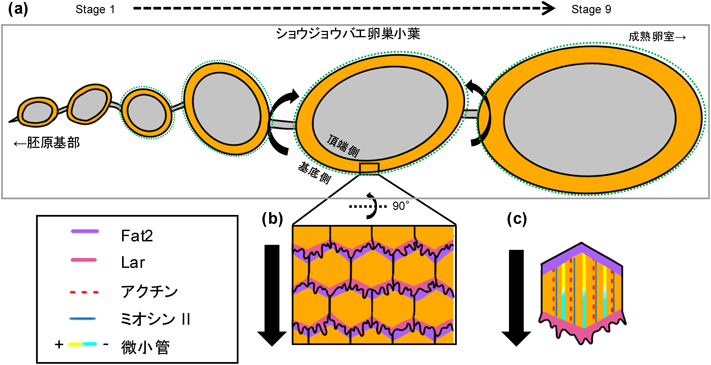
ショウジョウバエ卵室の回転は,卵巣内で卵室を取り囲む上皮細胞の集団が,基底膜に沿って一方向に回転運動する現象であり,リーダー細胞を伴わずに細胞集団全体が均等に動作する集団細胞移動の典型的な例の一つである7)(図3a).この現象は,卵室の対称的な発達と正確な構造の形成において重要な役割を果たしている.
卵室の回転運動には,Fat2およびLarと呼ばれる非典型的なカドヘリンファミリーのタンパク質が関与している35, 36).Fat2は細胞の後端に局在し,Larは細胞の前端に局在する(図3b).この二つのタンパク質は,細胞がアクチンフィラメントを介して基底膜に沿って移動する際の力学的な協調を調整し,回転運動を円滑に進行させる役割を果たしている.特にFat2は,回転方向に対して後続する細胞が前端に突出を形成する際のシグナルとして機能し,後続の細胞に運動の方向性を伝える(図3b).また,Larは回転方向に対して前端で細胞の突出形成を促進し,基底膜に沿った滑らかな移動を推進する(図3b).このように,細胞間での非細胞自律的なシグナル伝達により,卵室全体が調和のとれた運動を実現している
さらに,アクトミオシン系による収縮力が卵室回転の駆動力として重要である.アクトミオシンが細胞の形状を変え,隣接細胞との力学的な相互作用を通じて回転運動を推進し,正しい卵室の形態が形成される37)(図3c).この運動は,基底膜の分泌と剛性の調整によっても支えられており,Rab10依存的にコラーゲンIVやラミニンが基底膜に分泌され,回転運動を補助している38).
4)ショウジョウバエの胚帯伸長(GBE)
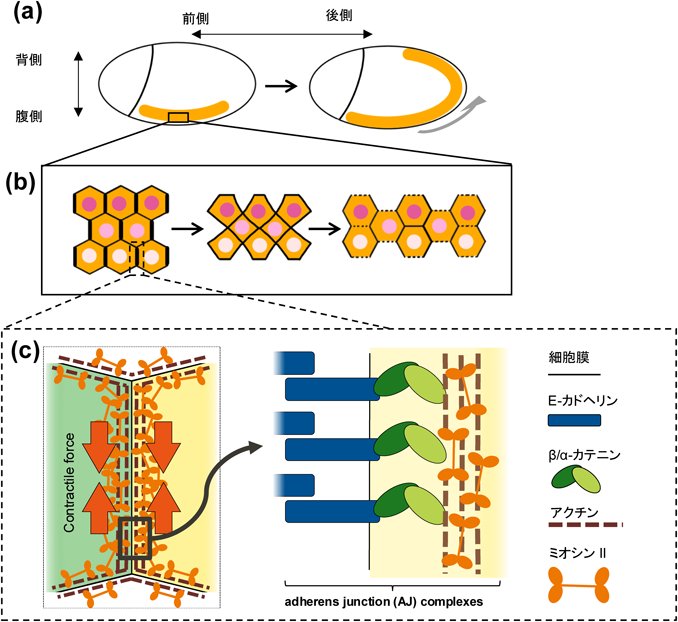
胚帯伸長(germ band extension:GBE)は,ショウジョウバエの初期発生過程における体軸伸長であり,リーダー細胞が存在せず,細胞集団全体が協調して動くことで伸長が達成される39–41)(図4a).GBEにおける集団細胞運動は,主に胚の背腹軸に沿った細胞の再配置によって達成され,胚帯が前後軸に沿って伸びる過程を指す.胚帯の細胞が胚体軸に沿って移動する際には,細胞接着部位のリモデリング(細胞接着リモデリングと以下略)が重要な役割を果たす41)(図4b).細胞接着リモデリングにおいてはまず,アクチンフィラメントやミオシンII, ROCKなどの分子が,接着部位において極性を持って蓄積され,接着部位の収縮を促進する(図4c).収縮した細胞間接着が消失することで,その両端に新たな細胞間接着が形成され,これが伸長することで,細胞接着リモデリングが完了する41, 42).ショウジョウバエ胚帯では,背腹軸に平行な細胞間接着部位が収縮し,背腹軸に垂直な新しい接着部位が形成される41).このプロセスにより,細胞は互いに挿入されるように動き,結果として胚帯全体が伸長する.このような現象は,収斂伸長と呼ばれる.
5)ショウジョウバエの雄性外生殖器の回転
ショウジョウバエの雄性外生殖器の回転は,発生過程において雄性外生殖器が前後軸を中心に約360度回転する現象であり43),その実態は外生殖器を取り囲む上皮細胞集団が協調した一方向の運動である44).この上皮細胞集団はリング状の上皮シート構造をとるために明確なリーダー細胞が発見されておらず,外部からの誘引シグナルによる制御を必要とせず,細胞間の相互作用と力学的な協調によって移動が成立していると考えられる8).この回転運動が途中で止まると,成虫の外生殖器の角度異常が示されて正常な交尾活動ができず,雄性不妊となる.
これらの事例を通じて,リーダー細胞非依存型の集団細胞運動も,多彩な器官形成において重要な役割を果たしていることが確認された.これらは,特定の方向へ向かうフリーエッジが存在しない場合や,細胞間の力学的な相互作用が強い場合に発現しやすい.今後,さらなる分子機構やシグナル伝達経路の解明が期待される.特に最後に記載した「ショウジョウバエの雄性外生殖器の回転」に関するメカニズムを主に解明したのは著者らであり,この関連研究について,以降の残りのページを割いてさらに詳しく解説する.
4. 回転する組織の一方向性集団移動:ショウジョウバエ雄性外生殖器の回転形成を例に
ここまで紹介してきた集団細胞移動の例において,リーダー細胞に依存するか否かにかかわらず,進行方向に対して細胞集団の先端辺縁部が存在する場合が多かった.しかし組織形成においては,必ずしもすべての細胞集団が明確な先端を持つわけではない.その典型例が,前の節で述べた,ショウジョウバエ卵室の回転7)と,ショウジョウバエ雄性外生殖器の回転8)である.この二つの大きな違いは,回転方向の規則性である.前者はランダムであり,後者は前後軸後方から見て時計回りに限定される.著者は,かれこれ20年近く,この「ショウジョウバエ雄性外生殖器の回転」のメカニズムを研究することで,この回転運動がリーダー細胞に依存せず,細胞集団全体が協調的に一方向へ移動することで達成されることが明らかした8, 44).ここからは,ショウジョウバエ雄性外生殖器の回転形成のメカニズムについて詳しく解説し,これを集団細胞移動の新たなモデルとして提示したい.
1)ショウジョウバエ雄性外生殖器の「回転」形成!?
ショウジョウバエの雄性外生殖器が回転しながら形成される現象は,1930年代にドイツ語の専門誌で初めて報告された43).この報告には数枚の不鮮明なスケッチが掲載されていたが,詳細な記述はなく,その後長い間,詳細なメカニズムは不明なままであった.しかし,現代の蛍光タンパク質を使ったライブイメージング技術により,著者らはショウジョウバエの生殖器が蛹期に回転する様子を詳細に観察することに成功した44).
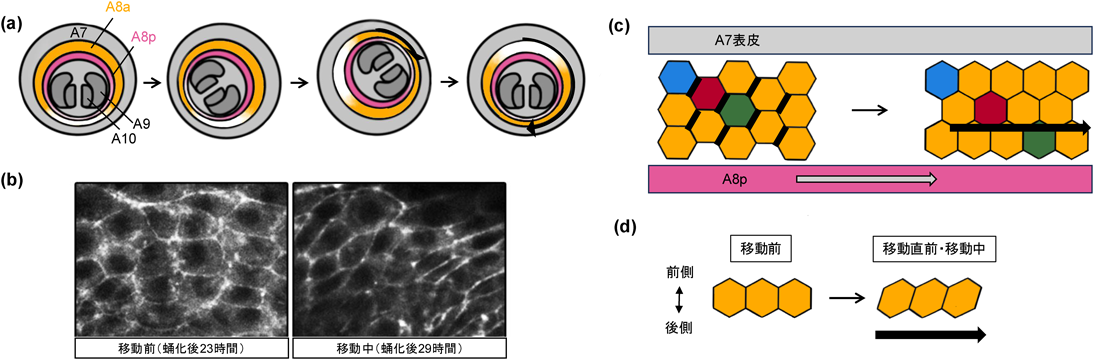
ライブイメージングの結果,蛹が形成されてから約24時間後に,雄性外生殖器が時計回りに回転を開始し,約12~14時間かけて360度回転することが確認された(図5a).また,回転の速度が一定ではなく,回転が進むにつれて「加速」することも明らかになった44).この現象が組織レベルでどのように制御されているのかを解明するため,まずショウジョウバエの生殖器原基(genital disc)の組織学的構造を理解する必要があった.生殖器原基は,ショウジョウバエの胚期に腹部第8(A8),第9(A9),第10(A10)体節の上皮由来細胞から形成される.A8は雄の生殖器背板(tergite)を形成し,A9は雄性外生殖器そのものを形成し,A10は肛門を形成する.蛹期の生殖器原基は蛹の後端に位置しており,A8がA7体節に接着してリング状の構造を形成し,その中心にA9とA10が配置されている(図5a).
著者らの研究では,回転時の細胞の動きを詳細に追跡することで,A8体節の細胞が集団で円周上を移動することを明らかにした.A8の前後軸に沿って後部側に位置する「内側リング(A8p)」と,同じく前部側に位置する「外側リング(A8a)」という二つの領域で異なる動態を示しており,内側リングはA9とともに見かけ上360度回転する一方,外側リングは180度だけ回転することが確認された(図5a).この仕組みは,細胞死抑制個体の解析から明らかになった.A8aまたはA8pにおいて細胞死を抑制した個体では,外側リングの動きが停止し,内側リングのみが,180度だけ回転した.この結果から,内側リングの180度の回転に外側のリングの180度の回転が加算されることで「動く歩道」のように内側リングが「加速」し,限られた発生ステージの時間内での360度回転を間に合わせていることが示唆された44).
従来の集団細胞移動モデルは主に,リーダー細胞が先導して集団全体を引っぱる形で運動が行われるものであった.しかし,外側リングで観察された移動は,構成する500個以上の上皮細胞がドーナツ型の単層シートを形成し,リーダー細胞の存在なしに集団として半周だけ回転するという特殊なものであった8).
外側リングでは多くの細胞集団移動で認められる進行方向を決定するリーダー細胞や進行方向への前縁部が欠落している.そのため,各細胞が同期して集団として動作する必要がある.このような細胞集団の動きは,従来の集団細胞移動モデルとは異なり,新しいメカニズムの理解が必要となる.
2)ミオシンIIに依存した左右非対称な細胞接着リモデリング
著者らは,カドヘリンにGFPを融合させたタンパク質により細胞間接着を標識することで外側リング回転時の細胞動態をライブイメージング観察した.その結果,A8外側リングの細胞は,隣接する細胞と接着した状態を保ちながらも収斂伸長でもみられた細胞接着リモデリングを頻繁に起こしつつ全体として時計回り方向に移動していることが確認された(図5b)8).
細胞接着リモデリングでは,ミオシンII分子が重要な役割を果たしている点である.Thomas Lecuit博士のグループは,細胞接着リモデリングが起こる際の細胞間接着領域でミオシンIIが特異的に蓄積し,その生成する収縮力が方向性のあるリモデリングを駆動することを報告している41)(図5c).著者らは,ミオシンIIが外側リング細胞移動において左右非対称に分布し,前後軸に対して右側に傾いた細胞間接着の収縮とそれに伴うリモデリングを誘導していることを確認した8)(図5b).この左右非対称なリモデリングの方向性は,ミオシンIIの左右非対称な分布と相関していた(図5b, c).また,ミオシンIIの発現を抑制すると,この方向性は消失し,結果として外生殖器の回転が不完全になった8).これにより,ミオシンIIの左右非対称な局在が,左右非対称な細胞接着リモデリングと,集団細胞の同期した一方向性の運動に必要であることが強く示唆された.
一方で,どのようにして左右非対称なミオシンIIの局在が制御されているか,その詳細な細胞内メカニズムはいまだ明らかでないが(著者らも鋭意解明中であるが),その解明の手がかりとして示されているのが,PCC(planer cell chirality)を制御するメカニズムである.PCCは,主に細胞頂端部側の細胞平面極性が,体軸の前後に対して左右非対称の形状を持つ現象として示されており,ショウジョウバエ初期胚の後腸捻転の方向が逆になるMyo31DF(MyoID)変異体を発見した松野健治教授のグループにより報告された45, 46).実際,Stephan Noselli博士のグループも,このMyoID変異体において,ショウジョウバエ外生殖器の回転方向が反時計回りに逆転することを発見している47).そこで著者らはまず,A8a上皮細胞におけるPCCを解析したところ,ミオシンIIの局在がみられるタイミングと一致して,集団細胞移動する直前および移動中にPCCが観察されることが明らかになった(図5d).加えてMyoIDのRNAi系統において,このPCCとミオシンIIの局在が反転していたことから,A8a細胞の左右非対称なミオシンIIの局在が,PCCと何らかの関連があることが明らかになった8).PCCの形成メカニズムを示唆する論文はその後いくつか報告されているが,まだ未解明の事象が多く,スペースの制限から本稿ではここまでにとどめたい.
これらの結果に基づき,細胞接着リモデリングによる新たな集団細胞移動モデルを提唱した(図5c).通常の収斂伸長では,前後軸に垂直な細胞接着面が収縮し,組織が前後軸に沿って伸長する41).しかし,A8aではミオシンIIの作用により,前後軸に対して右斜め方向の接着面が収縮するため,組織は左上から右下にかけて伸展しようとする.ただし,A8aは腹部第7体節(A7)とA8pに挟まれており,前後軸方向の伸展は物理的に制限されている.さらに,A8aの前部に接触しているA7は移動しないため,結果的にA8aの細胞群は右方向へと押し出されるようにして移動する.これは,左右非対称な細胞接着リモデリングが,一方向への上皮細胞の移動を促進するという新たな発見である.
3)数理モデルによる細胞接着リモデリングを介した集団細胞移動の検証
一方で,左右非対称な細胞接着リモデリングが,本当に一方向性の集団細胞移動を誘導できるのか,という疑問は残されていた.それを検証するために,数理モデルを用いたシミュレーションを行った.近年,集団細胞の挙動を予測する際に広く用いられている手法にバーテックスモデルがある48).このモデルでは,細胞を二次元の多角形として簡略化し,平面上に隙間なく配置する.細胞接着面に相当する多角形の辺に力学的なパラメータを与えることで,頂点間の張力などをシミュレーションし,細胞群の動態を解析する.また,細胞接着リモデリングは,このモデルにおいて頂点間の接近と分離による辺の消失や再形成として表現され,辺のリモデリングとしてシミュレーションされる.バーテックスモデルが発生現象の解析に利用された例として,前述した,PCCが関与するショウジョウバエ胚の後腸捻転があげられる45).この現象では,捻転前に後腸の細胞形状に左右非対称性がみられ,捻転後にはこの非対称性が消失する.この現象を再現するために,左右非対称な多角形で円筒を構築し,収縮力を付与することで多角形が左右対称となるようにシミュレーションを行った.その結果,非対称性が解消されるとともに円筒が反時計回りに捻転し,細胞の左右非対称性が捻転に寄与していることが示唆された45).ほかにも,ニワトリ神経板の前後軸に沿った細胞の折れ曲がりや,ショウジョウバエの肢節形成におけるアポトーシスによる張力変化など,バーテックスモデルはさまざまな現象においても有効に活用されている49, 50).
そこでA8aの細胞移動をシミュレーションするため,まずは二次元平面に多角形を敷き詰め,シンプルな条件下で解析を行った.観察結果に基づき,前後軸に対して45度右に傾く辺に強い収縮力が働くようにパラメータを設定した.この条件でシミュレーションを行うと,多角形は辺のリモデリングを繰り返しながら移動し,特に平面の上部に配置された多角形は左方向へ,下部の多角形は右方向へと移動した.これをさらに現実に即した形で再現するため,A7セグメントに相当する多角形を上端の境界に固定し,A8aの細胞のみが動くよう設定したところ,A8aの細胞に相当する多角形は右方向への移動を示した.次に,A8aをドーナツ状の平面に置き換えたin vivoに近いシミュレーションを行った.外側の円周にはA7の細胞,内側の円周にはA8pとの境界を設定し,前後軸は円の中心から放射状に定義した.さらに,収縮力にゆらぎを加え,実際の収縮・伸張時にみられる振動を再現した.この条件下でシミュレーションを実施したところ,多角形は継続的に右方向へ移動し,観察された実際の細胞移動と類似する結果が得られた.また,リモデリングは前後軸に対して右側に傾いた辺に集中し,接着面の極性も再現されていた.さらに,収縮力の最大角度を右回り45度から広範囲に設定しても,依然として多角形は右方向へ移動した.これらの結果から,左右非対称な細胞接着リモデリングが方向性を持つ集団細胞移動を駆動する重要な要因であることが強く示唆された8)(図5c).
以上のように,ライブイメージング観察および数理シミュレーションの結果から,リーダー細胞が存在しない上皮集団細胞の時計回りの移動という複雑にみえる現象が,左右非対称な細胞接着リモデリングというシンプルなメカニズムによって実現されていることが明らかになった.
4)Sidekickの関与
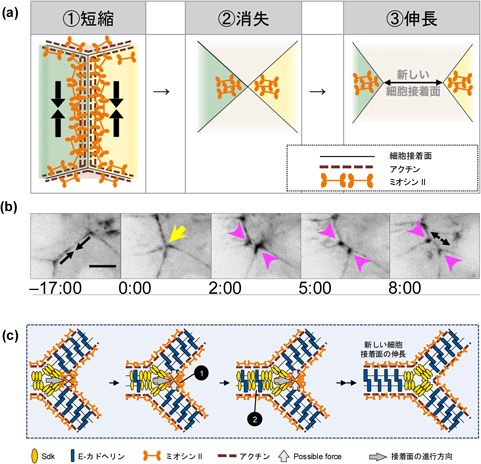
生殖器回転における集団細胞移動では,細胞接着リモデリングが重要な役割を果たしていることは,これまでの説明でご理解いただけたのではないかと思う.しかしながら,バーテックスモデルによる数理シミュレーションから,細胞接着リモデリングだけではなく,そのプロセスがスムーズに進行し,連続的でなければ移動は停止してしまうことが予想された.細胞接着リモデリングの仕組みとしてわかっていたことは,①隣り合う細胞の細胞接着面にミオシンIIが集積すると,その細胞接着面は短縮し,②やがて消失して四つの細胞が1点で接する点を形成し,③さらに,この接合点から新たな細胞接着面が,元の接着面とは垂直方向に伸張する,と三段階に大別される(図6a).この③の,新規細胞接着を伸長させる過程がリモデリングの完遂と継続に必要であるが,そのメカニズムが十分に解明されていなかった.
著者らは,細胞移動中のA8a細胞どうしの細胞接着リモデリングの過程を,GFPを付加したミオシンIIを用いてライブイメージングにより詳細に可視化したところ,①②の過程で収縮する細胞間接着で集積したミオシンIIが,③の新しい細胞接着面の両端に位置する3細胞接合(tricellular junction)でも継続して集積しており,この局所的なミオシンIIが伸長に寄与していることが示唆された(図6b)51).そこで,③のタイミングで光遺伝学によりtricellular junctionのミオシンIIを不活性化させて,新しい細胞接着面の伸長が抑制されるかどうか検証した.SuperNovaという光感受性(光を当てると活性酸素種を産生して近傍のタンパク質を不活性化させる)蛍光タンパク質をショウジョウバエの内在性ミオシンIIにノックインし,ライブイメージングで③のタイミングを確認しながら,tricellular junctionにあるミオシンIIを不活性化したところ,新しい細胞接着面の伸長が遅延することが明らかになった51).さらに著者らは,このtricellular junctionにミオシンIIを集積させるためにはSidekick(Sdk)という膜タンパク質が必要であることを見いだした51).このSdkは,E-カドヘリンと比較して物理的刺激に対する接着力は弱いものの,新規細胞接着面にカドヘリンよりも早く集積してアクトミオシンをつなぎ止め,まるで「ジッパー」のように3細胞接合点を移動させることで,新しい細胞接着面の伸長を誘導していることが明らかになった(図6c)51).これまで,細胞接着リモデリングにおいてE-カドヘリンを介した接着メカニズムが中心と考えられていたが,著者らの研究により,SdkがE-カドヘリンとは異なる分布と機能を持ち,特にtricellular junctionでの細胞接着面の延長に関与していることが示された.
Sdkはこれまで,シナプス形成や軸索ガイダンスにおいて重要な役割を果たしていることが知られていた52).しかし,今回の著者らの研究と,加えて同時期に報告された複数の研究により,Sdkが上皮細胞においても機能的に関与していることが新たに明らかとなった51, 53, 54.この発見は,上皮細胞の動的な細胞接着リモデリングの過程における3細胞接合点の役割を示すものであり,従来の形態形成における動的接着メカニズムに対する新たな視点を提供している.
5)集団細胞運動におけるPak3の関与とネガティブフィードバック機構
Pak(p21 activated kinase)は,RacやCdc42といったRhoファミリーGTPaseによって活性化されるセリン/トレオニンキナーゼであり,細胞骨格の制御や細胞運動,極性形成に関与している.ショウジョウバエには三つのPakタンパク質があるが,著者らの研究により,その一つであるPak3が,ショウジョウバエの雄性外生殖器回転において重要な役割を果たしていることが明らかとなった.これまでにPak3は,胚の背側閉鎖,幼虫表皮の創傷治癒,幼虫筋芽細胞の細胞間融合,卵母細胞内のボーダー細胞移動などへの関与が示されていた55–58).
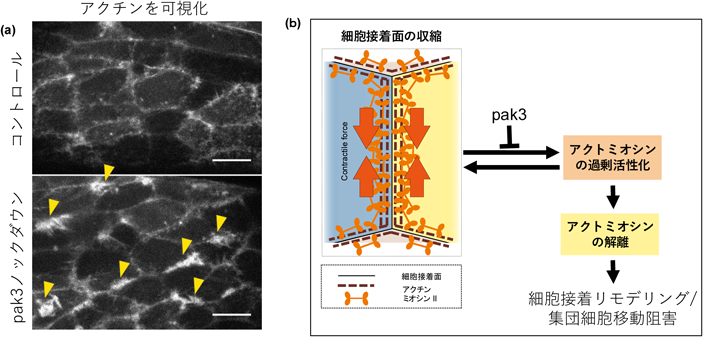
著者らは,Pak3をA8a細胞でノックダウンした際に,成虫ショウジョウバエ雄性外生殖器の角度異常表現型がみられることを発見し,その原因を蛹期のライブイメージングで解析した.その結果,Pak3を抑制したA8a細胞において,細胞接着リモデリングに異常がみられた.接着面は短縮を開始するものの,完全に消失することができずに再延長し,正常なリモデリングができないことが明らかになった59).また,アクチンのライブイメージングによって,Pak3のノックダウン細胞では,細胞間接着から伸長するアクチンの異常な突出が多数観察された(図7a)59).この異常なアクチンの突出出現頻度は,ミオシンIIのノックダウンにより細胞接着面の短縮を抑制させることで減少したため,接着面の短縮が引き金となっていることが示唆された.また,WAVE調節複合体の構成要素であるAbiやSCARを枯渇させることでも,異常な大きな突出の形成が抑制された59).WAVE調節複合体はArp2/3複合体を活性化し,それによりアクチンの枝状構造の形成を促進することから60, 61),分岐された枝状構造のアクチンネットワークが,Pak3ノックダウンによる異常なアクチン突出の構成要素であることが示唆された.これまでの研究でArp2/3複合体の抑制が,ショウジョウバエの胚帯伸長における,細胞接着リモデリングを介した細胞陥入(cell intercalation)を促進することが示されており62),Pak3の下流シグナルとして関与している可能性がある.加えて,Pak3ノックダウンにおいて,異常なアクチンの突出がみられる細胞間接着では,E-カドヘリンの減少と,接着面におけるミオシンIIの解離が観察されることが明らかになった59).この観察された接着面の分離は,異常なアクチン突出形成を抑制するような遺伝学的操作(前述したミオシンIIやWAVE調節複合体のノックダウン)や,E-カドヘリンの過剰発現により緩和され,Pak3ノックダウンで減少した接着面のリモデリング頻度を有意に回復させた59).このことから,異常なアクチンの突出は,局所的なE-カドヘリンの減少と,それに伴うミオシンIIケーブルの解離を介して,接着面の収縮を妨げることが示唆される.つまりPak3は,細胞接着リモデリング時の接着面短縮に伴うアクチンの異常な突出形成を防止し,細胞間接着面でのE-カドヘリンレベルを維持して,ミオシンIIを接着面近くに配置することで,持続的な接着面の収縮を担保することが明らかになった.
Pak3ノックダウンやPak3変異体の解析結果は,細胞間接着面のダイナミクス調節機構に,ネガティブフィードバック経路が存在することを示している(図7b).アクトミオシンによる収縮力が細胞接着面の短縮を駆動する際,この収縮力の上流にある活性化メカニズムが,WAVE調節複合体による枝状アクチンネットワークの形成とも部分的に関連している場合がある.このような場合,枝状アクチンネットワークの形成が分子分布を変化させ,結果として短縮動態が逆に妨げられることがある.これは,収縮力の誘導単独では目的とする収縮を達成できない可能性があり,収縮力と連携して,その収縮を妨害しないメカニズムが必要であることを示唆している.アクチンを介した収縮力を誘導する上流のシグナル経路と,力の生成中にアクチン動態を調整する下流メカニズムの両方が,細胞の適切な運動を厳密に制御している可能性がある.このようなネガティブ・フィードバックの微調整はアクチンによる収縮と拡張のような相反する動態が混在する上皮組織の形態形成にとって有益であると考える.
まとめると,Pak3は集団細胞移動におけるアクトミオシンの収縮力生成時に付髄するネガティブフィードバックを抑制して細胞移動のバランスを保つ役割を果たしている(図7b).このメカニズムは,特にショウジョウバエの雄性外生殖器回転のような,集団細胞がリーダー細胞なしに協調して移動する現象において不可欠なものであり,細胞接着リモデリング時の収縮と伸長の正確なタイミングを維持することで,細胞運動の一方向性とスムーズな進行を保証していると考える.
我々の体内では,リーダー細胞依存的な移動とリーダー細胞非依存的な移動が,調和しながら同時に機能しているのかもしれない.リーダー細胞依存的な移動では,先導する細胞が周囲の細胞に明確な方向を示し,集団全体がそのリーダーに従って組織的に移動する.この移動様式は,胚発生や創傷治癒など,生命の形成や回復においてきわめて重要であり,精密な組織配置を可能にしている.一方,リーダー細胞非依存的な移動では,細胞間の自律的な連携が鍵となる.リーダーがいないにもかかわらず,細胞どうしが協調して同じ方向に動き,外部環境や損傷などの変化に柔軟に対応することができる.このように,リーダー細胞依存と非依存の二つの移動様式が,同一個体内で状況に応じて使い分けられることで,生物は高い適応力とロバストさを実現している.
しかし,この二つの移動方式がどのようにして共存し,効率的に機能しているのかについては,まだ多くの謎が残されている.たとえば,集団細胞移動を車の渋滞やマラソンにたとえることができる.通常,先頭の車が動いても,後方の車が動き出すまでには時間差が生じる.同様に,マラソンでも,先頭のランナーが走り出してから後方のランナーがスタートラインを超えるまでには大きな遅れがある.にもかかわらず,生体内の細胞移動では,リーダー細胞が動き出すと,後方のフォロワー細胞もほぼ同時に反応し,集団全体がまるで一体となったかのように動き出す.なぜこのような同期が可能なのか? 細胞間での情報伝達がどれほど効率的に行われているのか,またどのようなメカニズムで集団全体が一斉に動き出すのかは,いまだに解明されていない大きな謎の一つである.
これらの問いに答えることができれば,生体のロバストさと適応力をさらに深く理解することができるだろう.リーダーとフォロワー,指揮と協調という二つの相反する力が,どのようにして一つの個体内で共存し,効率的に機能しているのか.この高度なシステムを解明することは,再生医療やバイオエンジニアリングの分野に新たな知見をもたらし,さらには生命そのものへの理解を深めることにつながるかもしれない.
今後の研究が,この細胞移動という一見単純にみえる現象の背後に潜む複雑で精巧な仕組みをどこまで解明できるのか.そして,それが我々の科学技術や医療にどのような革新をもたらすのか.これらの謎を追い求めることで,我々は生命の本質に一歩近づくことができるのかもしれない.
引用文献References
1) Friedl, P. & Gilmour, D. (2009) Collective cell migration in morphogenesis, regeneration and cancer. Nat. Rev. Mol. Cell Biol., 10, 445–457.
2) Mayor, R. & Etienne-Manneville, S. (2016) The front and rear of collective cell migration. Nat. Rev. Mol. Cell Biol., 17, 97–109.
3) Scarpa, E. & Mayor, R. (2016) Collective cell migration in development. J. Cell Biol., 212, 143–155.
4) Uechi, H. & Kuranaga, E. (2017) Mechanisms of collective cell movement lacking a leading or free front edge in vivo. Cell. Mol. Life Sci., 74, 2709–2722.
5) Uechi, H. & Kuranaga, E. (2018) Mechanisms of unusual collective cell movement lacking a free front edge in Drosophila. Curr. Opin. Genet. Dev., 51, 46–51.
6) Ewald, A.J., Brenot, A., Duong, M., Chan, B.S., & Werb, Z. (2008) Collective epithelial migration and cell rearrangements drive mammary branching morphogenesis. Dev. Cell, 14, 570–581.
7) Bilder, D. & Haigo, S.L. (2012) Expanding the morphogenetic repertoire: Perspectives from the Drosophila egg. Dev. Cell, 22, 12–23.
8) Sato, K., Hiraiwa, T., Maekawa, E., Isomura, A., Shibata, T., & Kuranaga, E. (2015) Left–right asymmetric cell intercalation drives directional collective cell movement in epithelial morphogenesis. Nat. Commun., 6, 10074.
9) Affolter, M., Zeller, R., & Caussinus, E. (2009) Tissue remodelling through branching morphogenesis. Nat. Rev. Mol. Cell Biol., 10, 831–842.
10) Lebreton, G. & Casanova, J. (2014) Specification of leading and trailing cell features during collective migration in the Drosophila trachea. Development, 127, 465–474.
11) Ghabrial, A.S. & Krasnow, M.A. (2006) Social interactions among epithelial cells during tracheal branching morphogenesis. Nature, 441, 746–749.
12) Cela, C. & Llimargas, M. (2006) Egfr is essential for maintaining epithelial integrity during tracheal remodelling in Drosophila. Development, 133, 3115–3125.
13) Duchek, P., Somogyi, K., Jékely, G., Beccari, S., & Rørth, P. (2001) Guidance of cell migration by the Drosophila PDGF/VEGF receptor. Cell, 107, 17–26.
14) Duchek, P. & Rørth, P. (2001) Guidance of cell migration by EGF receptor signaling during Drosophila Oogenesis. Science, 291, 131–133.
15) Gerhardt, H., Golding, M., Fruttiger, M., Ruhrberg, C., Lundkvist, A., Abramsson, A., Jeltsch, M., Mitchell, C., Alitalo, K., Shima, D., et al. (2003) VEGF guides angiogenic sprouting utilizing endothelial tip cell filopodia. J. Cell Biol., 161, 1163–1177.
16) Ruhrberg, C., Gerhardt, H., Golding, M., Watson, R., Ioannidou, S., Fujisawa, H., Betsholtz, C., & Shima, D.T. (2002) Spatially restricted patterning cues provided by heparin-binding VEGF-A control blood vessel branching morphogenesis. Genes Dev., 16, 2684–2698.
17) David, N.B., Sapède, D., Saint-Etienne, L., Thisse, C., Thisse, B., Dambly-Chaudière, C., Rosa, F.M., & Ghysen, A. (2002) Molecular basis of cell migration in the fish lateral line: Role of the chemokine receptor CXCR4 and of its ligand, SDF1. Proc. Natl. Acad. Sci. USA, 99, 16297–16302.
18) Ghysen, A. & Dambly-Chaudière, C. (2007) The lateral line microcosmos. Genes Dev., 21, 2118–2130.
19) Haas, P. & Gilmour, D. (2006) Chemokine signaling mediates self-organizing tissue migration in the zebrafish lateral line. Dev. Cell, 10, 673–680.
20) Valentin, G., Haas, P., & Gilmour, D. (2007) The chemokine SDF1a coordinates tissue migration through the spatially restricted activation of Cxcr7 and Cxcr4b. Curr. Biol., 17, 1026–1031.
21) Donà, E., Barry, J.D., Valentin, G., Quirin, C., Khmelinskii, A., Kunze, A., Durdu, S., Newton, L.R., Fernandez-Minan, A., Huber, W., et al. (2013) Directional tissue migration through a self-generated chemokine gradient. Nature, 503, 285–289.
22) Watson, C.J. & Khaled, W.T. (2008) Mammary development in the embryo and adult: A journey of morphogenesis and commitment. Development, 135, 995–1003.
23) Huebner, R.J., Lechler, T., & Ewald, A.J. (2014) Developmental stratification of the mammary epithelium occurs through symmetry-breaking vertical divisions of apically positioned luminal cells. Development, 141, 1085–1094.
24) Huebner, R.J. & Ewald, A.J. (2014) Cellular foundations of mammary tubulogenesis. Semin. Cell Dev. Biol., 31, 124–131.
25) Shamir, E.R. & Ewald, A.J. (2014) Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat. Rev. Mol. Cell Biol., 15, 647–664.
26) Ewald, A.J., Huebner, R.J., Palsdottir, H., Lee, J.K., Perez, M.J., Jorgens, D.M., Tauscher, A.N., Cheung, K.J., Werb, Z., & Auer, M. (2012) Mammary collective cell migration involves transient loss of epithelial features and individual cell migration within the epithelium. J. Cell Sci., 125, 2638–2654.
27) Walck-Shannon, E. & Hardin, J. (2014) Cell intercalation from top to bottom. Nat. Rev. Mol. Cell Biol., 15, 34–48.
28) Gjorevski, N. & Nelson, C.M. (2011) Integrated morphodynamic signalling of the mammary gland. Nat. Rev. Mol. Cell Biol., 12, 581–593.
29) Daniel, C.W., Robinson, S., & Silberstein, G.B. (1996) The role of TGF-β in patterning and growth of the mammary ductal tree. J. Mammary Gland Biol. Neoplasia, 1, 331–341.
30) Silberstein, G.B. & Daniel, C.W. (1987) Reversible inhibition of mammary gland growth by transforming growth factor-beta. Science, 237, 291–293.
31) Nelson, C.M., Vanduijn, M.M., Inman, J.L., Fletcher, D.A., & Bissell, M.J. (2006) Tissue geometry determines sites of mammary branching morphogenesis in organotypic cultures. Science, 314, 298–300.
32) Onodera, T., Sakai, T., Hsu, J.C., Matsumoto, K., Chiorini, J.A., & Yamada, K.M. (2010) Btbd7 regulates epithelial cell dynamics and branching morphogenesis. Science, 329, 562–565.
33) Chi, X., Michos, O., Shakya, R., Riccio, P., Enomoto, H., Licht, J.D., Asai, N., Takahashi, M., Ohgami, N., Kato, M., et al. (2009) Ret-dependent cell rearrangements in the Wolffian duct epithelium initiate ureteric bud morphogenesis. Dev. Cell, 17, 199–209.
34) Packard, A., Georgas, K., Michos, O., Riccio, P., Cebrian, C., Combes, A.N., Ju, A., Ferrer-Vaquer, A., Hadjantonakis, A.K., Zong, H., et al. (2013) Luminal mitosis drives epithelial cell dispersal within the branching ureteric bud. Dev. Cell, 27, 319–330.
35) Squarr, A.J., Brinkmann, K., Chen, B., Steinbacher, T., Ebnet, K., Rosen, M.K., & Bogdan, S. (2016) Fat2 acts through the WAVE regulatory complex to drive collective cell migration during tissue rotation. J. Cell Biol., 212, 591–603.
36) Barlan, K., Cetera, M., & Horne-Badovinac, S. (2017) Fat2 and Lr define a basally localized planar signaling system controlling collective cell migration. Dev. Cell, 40, 467–477.e5.
37) Viktorinová, I., Henry, I., & Tomancak, P. (2017) Epithelial rotation is preceded by planar symmetry breaking of actomyosin and protects epithelial tissue from cell deformations. PLoS Genet., 13, e1007107.
38) Isabella, A.J. & Horne-Badovinac, S. (2016) Rab10-mediated secretion synergizes with tissue movement to build a polarized basement membrane architecture for organ morphogenesis. Dev. Cell, 38, 47–60.
39) Irvine, K.D. & Wieschaus, E. (1994) Cell intercalation during Drosophila germband extension and its regulaton by pair-rule segmentation genes. Development, 120, 827–841.
40) Zallen, J.A. & Wieschaus, E. (2004) Patterned gene expression directs bipolar planar polarity in Drosophila. Dev. Cell, 6, 343–355.
41) Bertet, C., Sulak, L., & Lecuit, T. (2004) Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature, 429, 667–671.
42) Collinet, C., Rauzi, M., Lenne, P., & Lecuit, T. (2015) Local and tissue-scale forces drive oriented junction growth during tissue extension. Nat. Cell Biol., 17, 1247–1258.
43) Gleichauf, R. (1936) Anatomie und Variabilität des Geschlechtsapparates von Drosophila melanogaster (Meigen). Z. Wiss. Zool., 148, 1–66.
44) Kuranaga, E., Matsunuma, T., Kanuka, H., Takemoto, K., Koto, A., Kimura, K.-I., & Miura, M. (2011) Apoptosis controls the speed of looping morphogenesis in Drosophila male terminalia. Development, 138, 1493–1499.
45) Taniguchi, K., Maeda, R., Ando, T., Okumura, T., Nakazawa, N., Hatori, R., Nakamura, M., Hozumi, S., Fujiwara, H., & Matsuno, K. (2011) Chirality in planar cell shape contributes to left–right asymmetric epithelial morphogenesis. Science, 333, 339–341.
46) Hozumi, S., Maeda, R., Taniguchi, K., Kanai, M., Shirakabe, S., Sasamura, T., Spéder, P., Noselli, S., Aigaki, T., Murakami, R., et al. (2006) An unconventional myosin in Drosophila reverses the default handedness in visceral organs. Nature, 440, 798–802.
47) Spéder, P., Adám, G., & Noselli, S. (2006) Type ID unconventional myosin controls left-right asymmetry in Drosophila. Nature, 440, 803–807.
48) Honda, H., Nagai, T., & Tanemura, M. (2008) Two different mechanisms of planar cell intercalation leading to tissue elongation. Dev. Dyn., 237, 1826–3186.
49) Nishimura, T., Honda, H., & Takeichi, M. (2012) Planar cell polarity links axes of spatial dynamics in neural-tube closure. Cell, 149, 1084–1097.
50) Monier, B., Gettings, M., Gay, G., Mangeat, T., Schott, S., Guarner, A., & Suzanne, M. (2015) Apico-basal forces exerted by apoptotic cells drive epithelium folding. Nature, 518, 245–248.
51) Uechi, H. & Kuranaga, E. (2019) The tricellular junction protein sidekick regulates vertex dynamics to promote bicellular junction extension. Dev. Cell, 50, 327–338.e5.
52) Yamagata, M., Weiner, J. A., & Sanes J. R. (2002) Sidekicks: synaptic adhesion molecules that promote lamina-specific connectivity in the retina. Cell, 110, 649–660.
53) Finegan, T.M., Hervieux, N., Nestor-Bergmann, A., Fletcher, A.G., Blanchard, G.B., & Sanson, B. (2019) The tricellular vertex-specific adhesion molecule Sidekick facilitates polarised cell intercalation during Drosophila axis extension. PLoS Biol., 17, e3000522.
54) Letizia, A., He, D.Q., Astigarraga, S., Colombelli, J., Hatini, V., Llimargas, M., & Treisman, J.E. (2019) Sidekick is a key component of tricellular adherens junctions that acts to resolve cell rearrangements. Dev. Cell, 50, 313–326.e5.
55) Duan, R., Jin, P., Luo, F., Zhang, G., Anderson, N., & Chen, E.H. (2012) Group I PAKs function downstream of Rac to promote podosome invasion during myoblast fusion in vivo. J. Cell Biol., 199, 169–185.
56) Bahri, S., Wang, S., Conder, R., Choy, J., Vlachos, S., Dong, K., Merino, C., Sigrist, S., Molnar, C., Yang, X., et al. (2010) The leading edge during dorsal closure as a model for epithelial plasticity: Pak is required for recruitment of the Scribble complex and septate junction formation. Development, 137, 2023–2032.
57) Baek, S.H., Cho, H.W., Kwon, Y.C., Lee, J.H., Kim, M.J., Lee, H., & Choe, K.M. (2012) Requirement for Pak3 in Rac1-induced organization of actin and myosin during Drosophila larval wound healing. FEBS Lett., 586, 772–777.
58) Felix, M., Chayengia, M., Ghosh, R., Sharma, A., & Prasad, M. (2015) Pak3 regulates apical-basal polarity in migrating border cells during Drosophila oogenesis. Development, 142, 3692–3703.
59) Uechi, H., Fukushima, K., Shirasawa, R., Sekine, S., & Kuranaga, E. (2022) Inhibition of negative feedback for persistent epithelial cell–cell junction contraction by p21-activated kinase 3. Nat. Commun., 13, 1–12.
60) Lecuit, T., Lenne, P.-F., & Munro, E. (2011) Force generation, transmission, and integration during cell and tissue morphogenesis. Annu. Rev. Cell Dev. Biol., 27, 157–184.
61) Krause, M. & Gautreau, A. (2014) Steering cell migration: Lamellipodium dynamics and the regulation of directional persistence. Nat. Rev. Mol. Cell Biol., 15, 577–590.
62) Bertet, C., Rauzi, M., & Lecuit, T. (2009) Repression of Wasp by JAK/STAT signalling inhibits medial actomyosin network assembly and apical cell constriction in intercalating epithelial cells. Development, 136, 4199–4212.