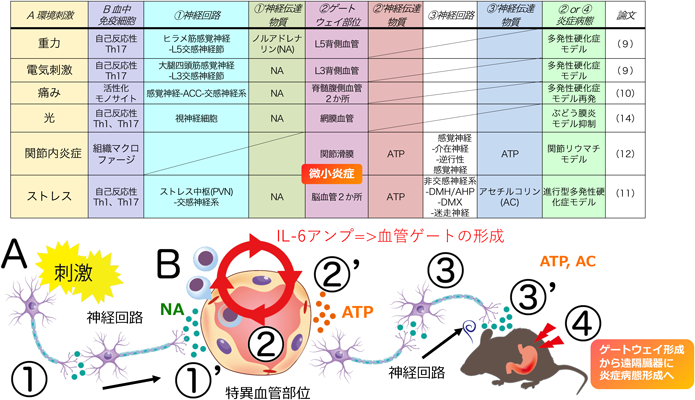
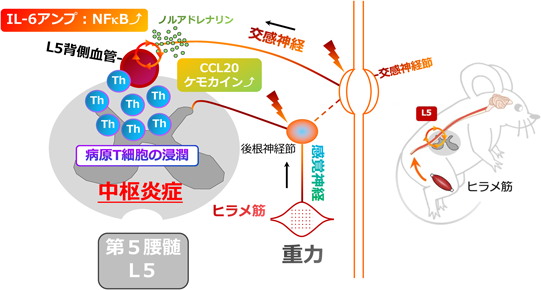
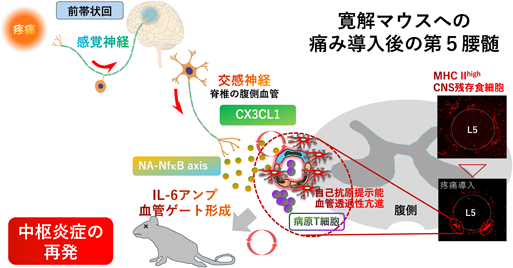
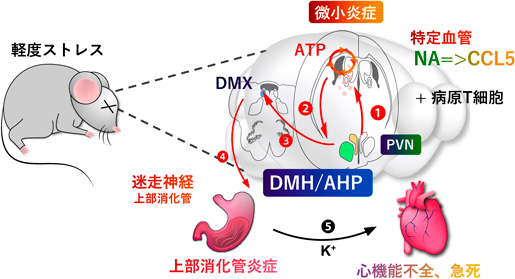
神経回路による組織特異的な炎症性疾患の制御:ゲートウェイ反射を例にRegulation of tissue-specific inflammatory diseases by neural circuits:The case of the gateway reflex
1 北海道大学遺伝子病制御研究所分子神経免疫学分野Division of Psychoimmunology, Institute for Genetic Medicine, Hokkaido University ◇ 〒064–0815 札幌市北区北15条西7丁目 ◇ W-7, N-15, Kitaku, Sapporo 064–0815, Japan
2 量子科学技術研究開発機構量子生命研究所量子免疫学チームQuantumimmunology Team, Institute for Quantum Life Science, National Institute for Quantum and Radiological Science and Technology ◇ 〒263–8555 千葉県千葉市稲毛区穴川4–9–1 ◇ 4–9–1 Anagawa, Inage-ku, Chiba-shi, Chiba 263–8555, Japan
3 自然科学研究機構生理学研究所分子神経免疫研究部門Division of Molecular Neuroimmunology, Department of Homeostatic Regulation, National Institute for Physiological Sciences, National Institutes of Natural Sciences ◇ 〒444–8585 愛知県岡崎市明大寺町字西郷中38 ◇ 38 Nishigonaka, Myodaiji-cho, Okazaki, Aichi 444–8585, Japan