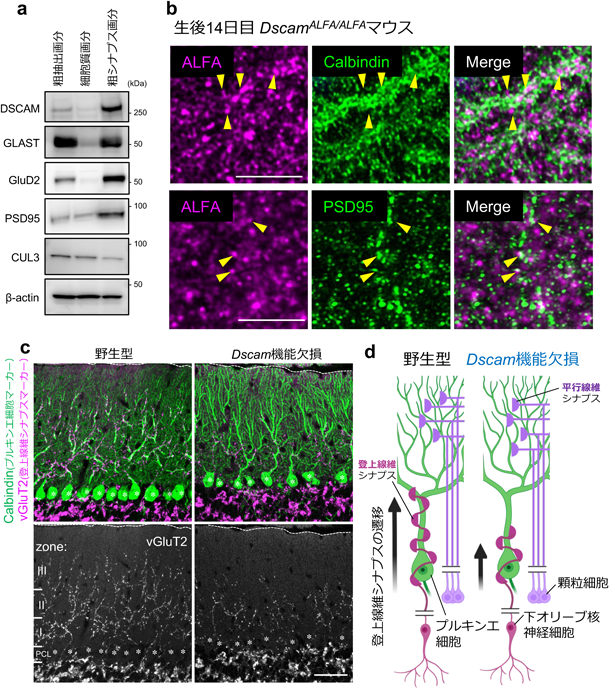
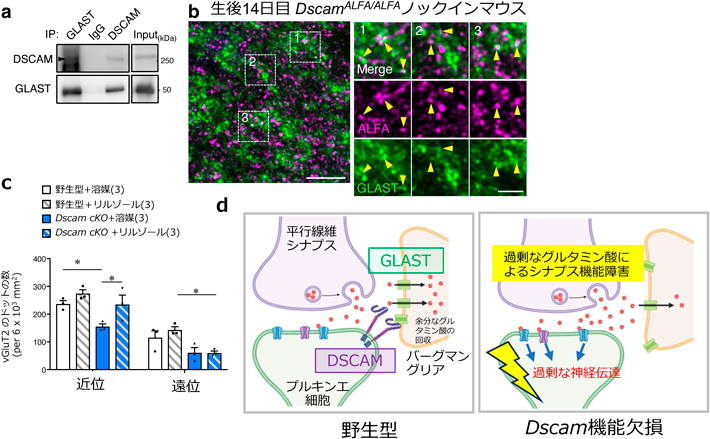
ダウン症関連遺伝子DSCAMによる過剰グルタミン酸の除去を介したシナプス形成機構Synaptic formation mechanism via DSCAM-mediated excess glutamate clearance
東北大学大学院薬学研究科Department of Pharmacology, Graduate School of Pharmaceutical Science, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区荒巻字青葉6–3 ◇ 6–3 Aoba, Aramaki, Aoba-ku, Sendai, Miyagi 980–8578, Japan