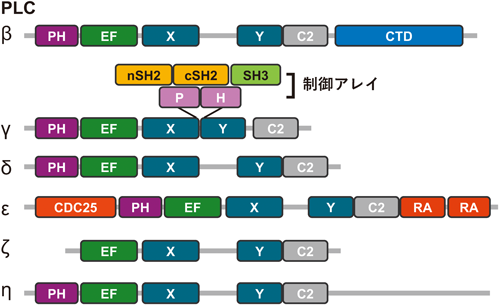
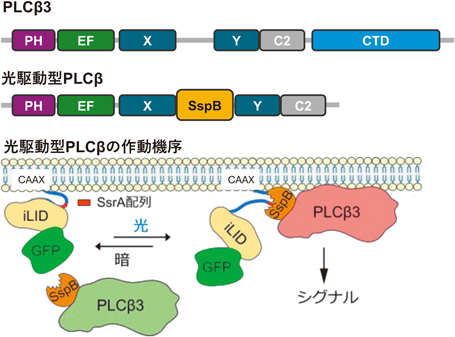
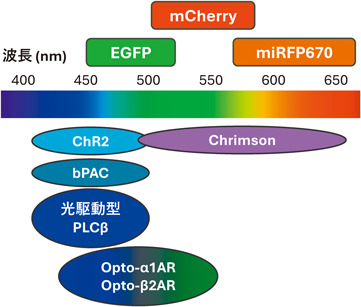
光によるPLC活性制御ツールの開発と神経可塑性調節への応用Development of optogenetic tools for controlling PLC activity and their application in modulating neural plasticity
山梨大学医学部生化学講座第一教室Department of Biochemistry, Faculty of Medicine, University of Yamanashi ◇ 〒409–3898 山梨県中央市下河東1110 ◇ 1110 Shimokato, Chuo, Yamanashi 409–3898, Japan