1. 糖鎖合成酵素遺伝子へのタグのノックインによる局在の解明
タンパク質への糖鎖付加はタンパク質の生理的機能に必須である.この糖鎖付加は複数の糖鎖合成酵素(糖転移酵素)が順序正しく作用することで起こり,多彩な機能を発現するための基盤となる複雑な糖鎖構造が厳密に制御されている.このような制御機構を知るため,以前から糖鎖合成酵素のゴルジ体内における局在の解析が行われていたが,過剰発現系での実験が主であり,糖鎖合成酵素が生理的な発現状態でゴルジ槽(cisternae)の平面内のどこに局在するかこれまでよくわかっていなかった.ゴルジ槽内の糖鎖修飾酵素の局在についての詳細な解析は,2018年に報告されたシンガポールのLuのグループが初めてと思われる1).Luらは,内在性あるいは発現させた糖鎖合成酵素やゴルジ体タンパク質のゴルジ槽内における局在を超解像顕微鏡(Airyscan共焦点顕微鏡)で詳細に調べているが,この方法では酵素の局在をゴルジ槽の中心からの距離の平均で示していることや,一部の酵素の局在はトランスフェクションによる過剰発現で解析しているため,内在性の酵素の互いの位置関係は依然としてわかっていなかった.
主な糖鎖修飾としてN-グリコシル化,O-グリコシル化,グリコサミノグリカン(GAG)による修飾がある.それぞれの糖鎖修飾は異なる機能をもつため,タンパク質がどの糖鎖修飾を受けるかによって糖タンパク質としての機能が制御される.我々は3種類の糖鎖合成の初期段階で働く三つの酵素,N型糖鎖合成酵素MGAT1(α-1,3-マンノシル糖タンパク質2-β-N-アセチルグルコサミン転移酵素1),O型糖鎖合成酵素GALNT6とGALNT7(ポリペプチドN-アセチルガラクトサミン転移酵素6あるいは7),およびGAG合成酵素XYLT2(キシロース転移酵素2)2)のゴルジ体における局在を比較するために,各遺伝子のコード領域のC末端にさまざまなタグをCRISPR/Cas9法を用いてノックインした3).
まずO型糖鎖合成酵素GALNTどうしの局在を比較すると,GALNT6とGALNT7はほぼ完全に共局在することが判明した.また,GALNTはコアタンパク質のセリン/トレオニン残基にN-アセチルガラクトサミン(GalNAc)残基を転移し,このGalNAc残基にC1GalT1(糖タンパク質-N-アセチルガラクトサミン3-β-ガラクトシルトランスフェラーゼ1)がガラクトース残基を転移する.このように連続して働く2種類の酵素の局在を調べた結果,C1GalT1はGALNT6とは若干異なる場所に局在した.このことは,GALTN6とC1GalT1による連続的な糖転移反応は空間的に若干異なる領域で行われることを示唆する.さらに,過剰発現系で糖鎖合成酵素の局在を解析した過去の結果の妥当性を検証するため,cDNAトランスフェクションにより発現させた酵素とタグのノックインにより標識した内在性酵素の局在を比較したところ,トランスフェクションした細胞ではノックイン細胞よりも酵素の局在が拡散していた.このことからトランスフェクションによる局在解析は内在性の酵素の局在解析には適していないと考えられる.
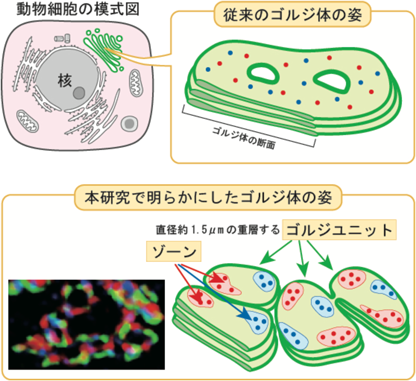
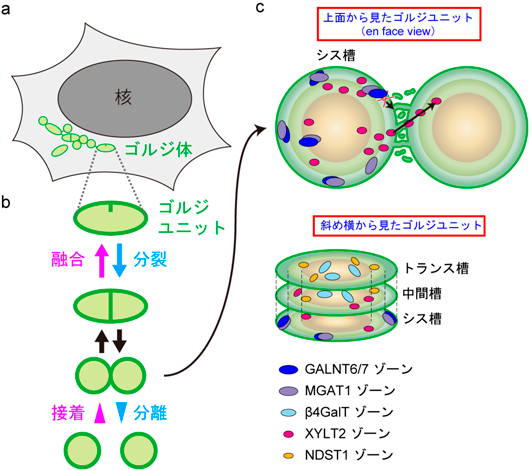
我々は,さらにN結合型糖鎖,O結合型糖鎖,およびGAGの生合成に関わる酵素の局在を比較した.この際,ゴルジ槽の辺縁に局在するgiantin1)を利用してゴルジ体の向きをそろえて解析を行った.酵素の局在解析には,高い時間的および空間的分解能を持ち,3次元で可視化できる超解像共焦点ライブイメージング顕微鏡法(SCLIM)を使用した4).また,解析の際は微小管脱重合剤であるnocodazoleを用いて大きなゴルジ体が1 µm程度の円盤状に分散したものを試料とした.我々はこの円盤状のゴルジ体をゴルジ体の機能的,構造的単位と考え,ゴルジユニットと命名した.
3種類のグリコシル化に関わる糖鎖合成酵素のゴルジ体における局在を同一細胞で比較するため,トリプルノックイン細胞(GALNT6-9xmyc+MGAT1-3xPA+XYLT2-3xV5)を作出し,GALNT6, MGAT1,およびXYLT2の局在を比較した.GALNT6とMGAT1の間の相関係数は非常に高く,それらがほぼ共局在することを示唆した.それに対し,GALNT6とXYLT2はあまり共局在していなかった.一つのゴルジユニット内でのそれらの局在を知るために,ゴルジユニットを側面と上面から観察した(図2には側面と上面から見たゴルジユニットの模式図を示した).
Luらは各酵素のゴルジ槽の中心からの平均距離を調べるにとどまったが,我々はより高い空間解像度で,個々のGALNT6とMGAT1, GALNT6とXYLT2の位置を同定したところ,側面からの観察でGALNT6, MGAT1, XYLT2はほぼ同じ高さ,つまりほぼ同じ槽にあることが示唆された.しかし上面からみると,GALNT6とMGAT1はgiantinの近傍でよく共局在するのに対し,GALNT6とXYLT2はあまり共局在しないようにみえた(図2右上).これらの糖鎖合成酵素は別々の小さな個別の領域を占めているため,これらの領域を「ゾーン」と呼ぶことにした(図1,図2).
我々は局在をより正確に調べるために,蛍光分子の中央点を同定できる局在顕微鏡(STORM)を利用した.この際,ゴルジユニットの辺縁に局在するgiantinと各酵素との局在の相関係数を算出することにより,それぞれの酵素が局在するゾーンが異なるかどうかを調べた.すると,GALNT6およびMGAT1とgiantinの相関係数は,XYLT2とgiantinの相関係数よりも高かった.さらに,これら三つの酵素の量を調べたところ,量の違いはあるものの,すべてが同じゴルジユニットで検出された.これらの結果から,3種の糖鎖合成酵素は同じゴルジユニット内に存在するが,N-およびO-グリコシル化とGAGによる修飾は異なるゾーンで起こる可能性が示唆された.さらにSTORMの画像から三つの酵素のゾーンの面積が異なるようにみえたため,面積を測定したところ,GALNT6, MGAT1,およびXYLT2のゾーンの直径はそれぞれ104±79, 92.7±5.5および77.0±3.9 nmと計算され,大きいGALNT6と小さいXYLT2の面積の間には有意差があった(ゾーンの大きさの意義については図2のレジェンドを参照).O型糖鎖合成酵素とGAG合成酵素の局在が異なるという結果に関して,2種の酵素が異なる槽(cisternae)にあるため異なる局在を示す,という可能性を排除するため,免疫電子顕微鏡による二重染色を行ったところ,これらは同じ槽にあったためその可能性は否定された.
GALNT6およびMGAT1はそれぞれO型あるいはN型糖鎖の生合成初期,XYLT2はGAG鎖の生合成初期に働く糖鎖合成酵素であるため,それぞれの糖鎖の生合成後期に働く糖鎖合成酵素のゴルジ体での局在についてもSCLIMで観察した.O型およびN型糖鎖の合成後期に関与するβ4GalT1(β1,4-ガラクトース転移酵素-I)はゴルジユニットの中央に局在した.β4GalT1とGAG合成の後期で働くNDST11(N-脱アセチル化/N-硫酸転移酵素1)の局在を,ゴルジ体を側面から見て比較すると両酵素はだいたい同じ槽にあったが,上面から見るとβ4GalT1の槽内での位置はNDST1より中央に近いことが確認された.次にゴルジ体を上面から観察することでGAG合成酵素どうしの局在を比較したところ,合成後期の酵素のNDST1は生合成初期に働くXYLT2と異なる位置にあることが判明した.つまりシス槽のXYLT2のゾーンはトランス槽のNDST1のゾーンの真上にはなく(図2右下),GAG合成に特化したゴルジの領域がシス槽からトランス槽まで垂直にそろって位置しているとは考えにくい結果であった.実際にGAG生合成酵素の基質となるタンパク質の一つ,シンデカン2がこれらのゾーンを通るかどうかを,可逆的タンパク質係留(retention using selective hooks:RUSH)法5)を用いて調べた.シンデカン2タンパク質は小胞体で合成された後,XYLT2によりキシロース残基が転移されることでGAG鎖の生合成が開始され,その後,NDST1によって硫酸化修飾が起こる.RUSH法によりシンデカン2の小胞体からゴルジ体への輸送をSCLIMで観察した結果,早い時期にシンデカン2はXYLT2ゾーンと高い相関性を示し,それよりも遅い時期にNDST1ゾーンとの相関が高くなることが判明した.これはGAG生合成において2種の酵素が作用する順番とも一致することから,我々が観察したゾーンは糖鎖合成の場であることが示唆された.
2. ゴルジ体全体はリング状の構造が横に連なって形成される
通常,ゴルジ体は細胞の核近くでクラスターを形成する.定常状態におけるゴルジ体の形態を調べるため,我々は超解像顕微鏡を用いてgiantinにより可視化したゴルジ体の形態をnocodazoleによる処理を行わない条件で観察した.ヒト結腸がん由来Caco2細胞ではnocodazoleなしでも直径1~3 µmのリング状の構造がみられた.この構造が,クラスターを作ってゴルジ体を形成する場合,それらが横につながっていることを観察した(図1下段).リング状の構造は直接接触することもあるが,tubule状の構造を介してつながっている様子も頻繁にみられた.糖鎖合成酵素は主にこれらのリング状構造の辺縁にみられたが,時折リング内にもみられた.このことはnocodazole処理でバラバラになっているときのゴルジユニット内の酵素の局在と同様であったため,我々はこのリング構造はゴルジユニットであると結論づけた.ユニットの大きさ(長径)はユニットが単独のときとクラスターになっているときでほとんど差はなく,またほかの細胞種でも同様の構造がみられた.このことから,哺乳類では細胞の種類に関係なく,普遍的にゴルジ体はゴルジユニットが連結された構造をとることが示唆された.またユニットが単独に存在する場合だけでなく,クラスターを作る場合も一つのユニット内にO型糖鎖,N型糖鎖,およびGAG鎖の生合成初期に働く糖鎖合成酵素がすべて含まれていたため,ゴルジユニットは構造的のみならず機能的にもゴルジ体の基本単位と考えられた.
3. 糖鎖合成酵素はユニット内,およびユニット間を活発に移動する
以上の結果はすべて固定した細胞で行われたため,生きた細胞でゴルジユニットの動態を調べるため,Caco2細胞にgiantin cDNAを導入しゴルジユニットの辺縁部を可視化後,ライブイメージングを行った.giantin等で囲まれたゴルジユニットの動態をみると,大きなゴルジユニットに仕切りが入って小さなユニットに切り分けられ,一部の小さなユニットは元のゴルジユニットの集団から分離して移動し,他の集団に接触したり,時にはゴルジユニットどうしがつながって大きなゴルジユニットになったりすることがわかった(詳細は文献3の動画データを参照).同様の動きは,内在性golgin84遺伝子に検出用のタグをノックインしてゴルジユニットを可視化した細胞でもみられたため,生理的な状態でもゴルジユニットの分裂や融合などの動きが起こると思われる.またこのようなゴルジユニットの動態は別の細胞株でも確認された.
次に糖鎖合成酵素のゾーンのダイナミクスをみるため,酵素遺伝子の3′末端にHaloタグをノックインし,SCLIMを用いてライブイメージングで観察した.まず,GALNT6とゴルジユニット辺縁に局在する分子(giantin, golgin84)を同時に可視化した.GALNT6は固定細胞同様にゴルジユニットの辺縁部に主に局在し活発に動き回る様子が観察された.またGALNT6はゴルジユニットから出ていくことはほとんどないようにみえた.さらに我々はXYLT2やNDST1のライブイメージングを行った.XYLT2, NDST1もGALNT6同様ゴルジユニットの辺縁近くを激しく動き回ることが観察された.GALNT6とXYLT2の動きに違いがあるかどうか調べるため,XYLT2-HaloとGALNT6-SNAPx2の二つを同時に発現させてライブイメージングを行ったところ,これら2種類の酵素のゾーンはほぼ相互排他的に動き回ることが明らかとなった.
最後にゴルジユニットが単独のとき,またクラスターを作るとき,GALNT6, XYLT2のゾーンがどのように移動するか調べるため,FRAP(fluorescence recovery after photobleaching)を行った.GALNT6については,ゴルジユニットが一つだけのときもクラスターを作るときも,photobleachで消退させたシグナルはほとんど回復しなかった.このことからゴルジユニット間でGALNT6の出入りはほとんど起きないことが示唆された.それに対してXYLT2については,ゴルジユニットが単独で存在する場合はphotobleach後の回復はほとんどないが,クラスター化して存在する場合は,非常に速く回復することが判明した.つまりXYLT2は隣接するゴルジユニット間を出たり入ったりしながら非常に活発に動き回っていることが示唆された.
4. giantinはゴルジユニットのクラスター化とそれによるGAG合成酵素の均一な局在に必要である
ゴルジユニットはgiantinによって囲まれるが,ゴルジ体の表面に存在することが知られるゴルジンと呼ばれる分子のうち,golgin84, TMF1(TATA element modulatory factor 1),GCC2(GRIP and coiled-coil domain containing 2)がgiantinと同様の局在を示すことを確認した.それらの分子のゴルジユニットにおける役割を調べるため,HeLa細胞でそれらの分子のノックダウン(KD)とノックアウト(KO)を行った.giantinのKDおよびKOはともにゴルジユニットを分散させるが,giantin cDNAの発現によって再度クラスター化することが判明した.同じ現象がCaco2細胞でgiantinをKOしたときにも確認された.giantin以外の分子のKDとKOでは,ゴルジユニットが分散する表現型が確認できなかったため,giantinはゴルジユニットのクラスター化に重要であることが示唆された.さらにgiantinのKDがO型糖鎖やGAG鎖の生合成に関わる酵素のゴルジユニットにおける分布に影響を与えるかどうかを調べた.giantin KDによって分散したゴルジユニットにおけるGALNT6のシグナルの強さは各ユニットの間でほぼ均一であったが,XYLT2のシグナルの強さは分散したゴルジユニット間で大きく異なっていた.つまり一部のゴルジユニットではXYLT2の量がかなり低下していた.そこでgiantin KDではGAG合成の効率が悪くなっているのではないかと考え,GAGの合成量を定量したところ,giantin KDで予想どおり大きく低下することが判明した.GAGによる修飾はプロテオグリカン(PG)の機能に重要であり,PGの生合成異常は骨や神経などの疾患に関連する.このためゴルジユニットのクラスター形成が正常なPGの合成に必要であるという結果は,ゴルジ体の微細な形態異常がPGの関連する疾患の原因となりうる可能性を示している.
以上の結果のまとめを図2に示す.
これまで,ゴルジ体は,「槽(cisternae)」と呼ばれる膜で包まれた扁平な袋が複数積み重なった層板構造をしていると考えられていた(図1上段右).我々はゴルジ槽が単なる大きな膜からできた構造ではなく,長径1~3 µmのゴルジユニットが集合してできていることを示した(図1下段).ゴルジ体がこのような構造を持つことは糖鎖合成のために大きなメリットがあると思われる.たとえば,一つのタンパク質上に複数の糖鎖修飾が起こることがよくあるが,本研究で明らかにしたゴルジ体の形態はこのような糖鎖修飾を行う上で有利に働くと考えられる.つまり,3種類の糖鎖修飾に関わる酵素が小さなゴルジユニットにすべて含まれ,それらがユニットの辺縁部を動き回ることで,短時間の間に酵素と基質タンパク質が高い確率で出会うことができるため,一つのタンパク質上に効率よく多くの種類の糖鎖修飾を行えるようにしていると考えられる.
では,ゴルジユニットが集合する生理的意義は何であろうか? ハエではゴルジ体が分散しており,異なるゴルジ体(ゴルジユニット)に異なる酵素が局在することが知られている6).また線虫や酵母,植物でもゴルジ体は分散して存在する.面白いことに哺乳類細胞でゴルジユニットが分散すると,O型糖鎖合成酵素(GALNT6)の量にはユニットごとの違いがないが,GAG合成酵素(XYLT2)の量はユニットごとの差が大きくなり,その結果GAGにより修飾されたPGの合成量が低下する.giantinノックアウトラットでは骨と軟骨の異常が生じることが知られる7)が,骨や軟骨ではPGが活発に合成されている.このことから,骨や軟骨組織を持たないハエや線虫,植物では,PGのGAGによる修飾を効率よく起こす必要がないためゴルジユニットは分散して存在していても問題はないが,骨軟骨がある脊椎動物以降,GAGによって修飾されたPGの合成効率を上げるためにゴルジユニットを集合させることが必要となった可能性が考えられる.
1)酵素の局在について
面白いことにN型,O型糖鎖修飾酵素の局在は近く,それらとGAG合成酵素の局在は異なることがわかった(図2).また,O型酵素の槽内の局在はシスおよびトランス槽で異なっており,シス槽のGALNT6はゴルジユニットの外縁近くに局在するのに対し,トランス槽のβ4GalT1はユニットの中央近くに局在することが判明した.それに対し,GAG合成酵素はシス槽のXYLT2,トランス槽のNDST1ともユニットの外縁に近い位置に局在することが判明した.
このことからO型修飾を受ける基質タンパク質はシスからトランス槽に進むにつれ,ゴルジユニットの周辺から中央に動くが,GAG修飾を受ける基質タンパク質はユニットの周辺部に局在したままシスからトランス槽に動く可能性がある.しかし,XYLT2, NDST1がライブイメージングでともに激しく動き回ることを考えると,基質は単純にシスからトランス槽に垂直方向に輸送されるとは考えにくい.今後ライブイメージングによって基質と酵素の相互関係を解明する必要がある.
2)ゴルジユニットのダイナミクスについて
これまでユニットを可視化した状態で高い時間・空間解像度でのライブイメージングは行われていなかったこと,ユニットの概念がなかったことから,ゴルジ体の動態の詳細は理解されていなかったが,本研究により,ゴルジユニットが融合,分裂,接着,分離を行うことがわかった.また,ゴルジユニットの構築の分子機構(何が辺縁を形成するか? なぜ直径が1~3 µmなのか?など)や,ゴルジユニットのダイナミクス(融合,分裂,接着,分離)の分子機構についても今後解析する必要がある.
3)ゾーンのダイナミクスについて
O型糖鎖生合成酵素(GALNT6),GAG生合成酵素(XYLT2)がユニットの外縁に沿って動き回ることが判明した.また,これらの酵素は固定サンプル同様に相互排他的な局在を示すことが判明した.このことからゾーンは互いに排除しあう性質を持つことが示唆された.今後これらのゾーンの性質を規定する分子機構について詳しく解析する必要がある.すでに近接ビオチン法を用いてこれらの酵素の近傍にある分子を同定済みであるため,これらの分子のKD, KOがゾーンに与える影響などを解析する予定である(図3).
またFRAPの結果から,サイズの小さなXYLT2ゾーンはサイズの大きなGALNT6ゾーンに比べてゴルジユニット間に存在する何らかのバリアを超えて動き回りやすい性質を持つと考えられるが,それはゾーンの大きさだけで説明可能かという点についても検証の必要がある.
引用文献References
1) Tie, H.C., Ludwig, A., Sandin, S., & Lu, L. (2018) The spatial separation of processing and transport functions to the interior and periphery of the Golgi stack. eLife, 7, e41301.
2) Varki, A., Cummings, R.D., Esko, J.D., Stanley, P., Hart, G.W., Aebi, M., Mohnen, D., Kinoshita, T., Packer, N.H., Prestegard, J.H., et al.(2022) Essentials of Glycobiology, 4th edition, Cold Spring Harbor Laboratory Press, New York.
3) Harada, A., Kunii, M., Kurokawa, K., Sumi, T., Kanda, S., Zhang, Y., Nadanaka, S., Hirosawa, K.M., Tokunaga, K., Tojima, T., et al. (2024) Dynamic movement of the Golgi unit and its glycosylation enzyme zones. Nat. Commun., 15, 4514.
4) Kurokawa, K., Ishii, M., Suda, Y., Ichihara, A., & Nakano, A. (2013) Live cell visualization of Golgi membrane dynamics by super-resolution confocal live imaging microscopy. Methods Cell Biol., 118, 235–242.
5) Boncompain, G., Divoux, S., Gareil, N., de Forges, H., Lescure, A., Latreche, L., Mercanti, V., Jollivet, F., Raposo, G., & Perez, F. (2012) Synchronization of secretory protein traffic in populations of cells. Nat. Methods, 9, 493–498.
6) Yano, H., Yamamoto-Hino, M., Abe, M., Kuwahara, R., Haraguchi, S., Kusaka, I., Awano, W., Kinoshita-Toyoda, A., Toyoda, H., & Goto, S. (2005) Distinct functional units of the Golgi complex in Drosophila cells. Proc. Natl. Acad. Sci. USA, 102, 13467–13472.
7) Suzuki, H., Fukaya, S., Saito, K., & Suzuki, K. (2000) A locus responsible for osteochondrodysplasia (ocd) is located on rat chromosome 11. Mamm. Genome, 11, 464–465.
著者紹介Author Profile
 原田 彰宏(はらだ あきひろ)
原田 彰宏(はらだ あきひろ)大阪大学医学系研究科細胞生物学教室 教授.博士(医学).
略歴1989年東京大学医学部卒業.同年同附属病院研修医.90年東京大学大学院医学系研究科博士課程入学.92年東京大学薬学部助手相当.95年東京大学医学部助手.96年同講師.2001年群馬大学生体調節研究所教授.09年大阪大学医学系研究科教授.現在に至る.
研究テーマと抱負これまで主に細胞極性の分子機構の解明をやってきましたが,ゴルジ体の仕事が非常に面白くなってきたため,残り少ない研究期間は,ゴルジ体やその酵素のダイナミクスと分子機構の解明に充てようと考えています.
ウェブサイトhttps://www.harada-lab.online/
趣味読書.映画鑑賞.たまに旨いものを食べること.