タンパク質や脂質の糖鎖修飾は,ゴルジ装置内の糖転移酵素によって段階的に行われる.N型糖鎖修飾においては,小胞体で新生糖タンパク質に結合した高マンノース型糖鎖は,小胞体やゴルジ装置内のマンノシダーゼによってトリミングされ,その後,さまざまな糖転移酵素によって,N-アセチルグルコサミン,ガラクトース,フコース,シアル酸などの付加を受けて糖鎖構造が多様化する.この過程には,ゴルジ装置内で糖転移酵素がシステマティックに配置されることが重要である.たとえば,マンノシダーゼはゴルジ装置のシス側に局在し,シアル酸転移酵素はトランス側に分布している.ゴルジ装置内では,N型糖鎖修飾のみならず,脂質の糖鎖付加やプロテオグリカン上のグリコサミノグリカン鎖の伸長も起こりうる.ショウジョウバエなどにおいては,ゴルジ装置は細胞内に分散したスタック構造を有するミニゴルジとして存在している.後藤らの研究では,ショウジョウバエにおいて異なる糖鎖修飾に関与するタンパク質が,異なるミニゴルジに配置されていることが報告されている1).一方,哺乳類細胞ではゴルジ装置は「ゴルジリボン」と呼ばれる広範な構造を形成している.
近年の顕微鏡技術の進展により,ゴルジ装置の構造が従来考えられていたよりも複雑であることが明らかとなり,糖転移酵素がそれぞれ独自の領域に分布して存在し,糖鎖修飾を制御している可能性が示唆されている.本稿では,我々の最近の研究を含め,哺乳類細胞における糖転移酵素の分布とその局在メカニズムについて紹介する.
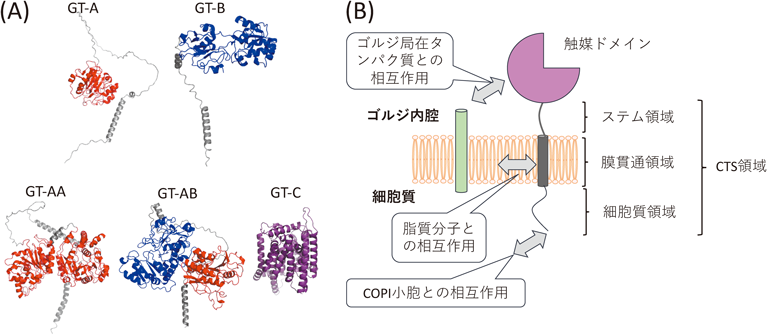
UniProtおよびGlyCosmos Portal databaseによると,ヒトには215種類の糖転移酵素が存在し,その多くが小胞体やゴルジ体に局在し,複合糖質の合成に関わっていることが知られている2).これらの酵素の触媒ドメインは,その構造からGT-A, GT-B, GT-Cの三つのクラスに分類される(図1A).中には,二つの触媒ドメインを有する糖転移酵素(GT-AA, GT-AB)も8種類存在している.GT-Cは,膜貫通型の糖転移酵素であり,活性部位は膜貫通ドメインの中にある.GT-C以外のほとんどの酵素は,触媒ドメイン,ステム領域,膜貫通領域,細胞質領域からなるII型膜タンパク質である(図1B).一部の糖転移酵素には,触媒ドメインに隣接するドメイン(Add-on)が,基質認識や複合体の形成に関わることも知られている2).
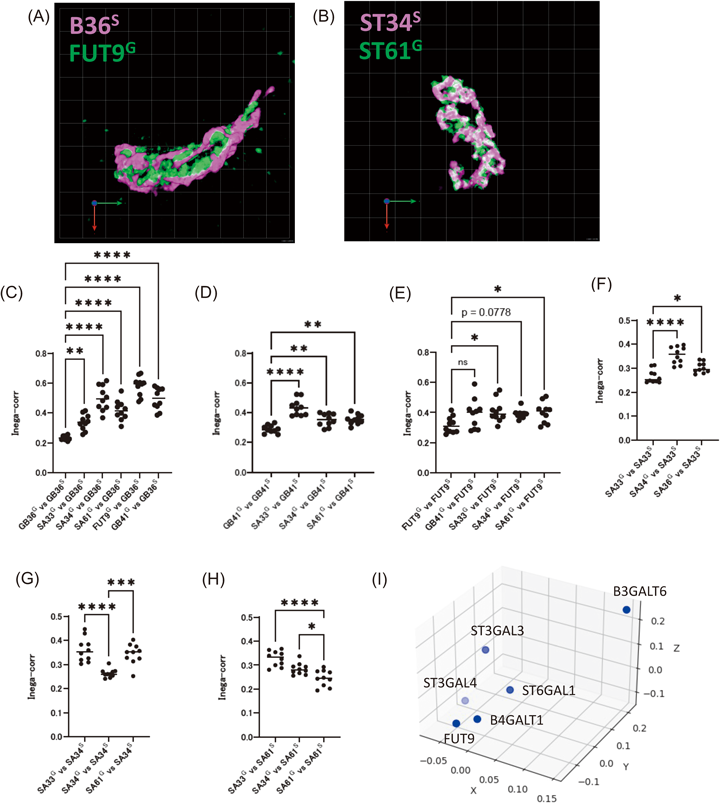
糖転移酵素は,複合糖質が生合成される領域と一致して分布している考えられているが,実際にどのようにゴルジ体に分布しているかは未解明な部分が多い.そこで,我々はsuper-resolution confocal live imaging microscopy(SCLIM)イメージング技術を用い,6種類の糖転移酵素(B3GALT6, ST3GAL3, ST3GAL4, ST6GAL1, FUT9, B4GALT1)を標的として,2種類ずつの3次元共局在を解析を実施した3)(図2A, B).B3GALT6は,メディアルゴルジ体に局在し,グリコサミノグリカンの合成に関わるβ1,3ガラクトース転移酵素である.一方で,残りの5種類の糖転移酵素(ST3GAL3, ST3GAL4, ST6GAL1, FUT9, B4GALT1)は,トランスゴルジ体に局在する酵素であり,糖タンパク質糖鎖の合成に関わることが知られている.ST3GAL3およびST3GAL4はα2,3シアル酸転移酵素,ST6GAL1はα2,6シアル酸転移酵素,FUT9はα1,3フコース転移酵素,B4GALT1はβ1,4ガラクトース転移酵素である.
まず,B3GALT6とトランスゴルジ体に局在する酵素(ST3GAL3, ST3GAL4, ST6GAL1, FUT9, B4GALT1)の各々とのゴルジ体内分布を比較した結果,それぞれの共局在度は低くかった(図2C).つまり,我々の解析からもB3GALT6とトランスゴルジ体に局在する酵素は,異なるゴルジ槽に分布することが示唆された.次に,トランスゴルジ体に存在する糖転移酵素間の共局在度を定量化した結果,B4GALT1とFUT9の共局在度は高かったが,B4GALT1とシアル酸転移酵素(ST3GAL3, ST3GAL4, ST6GAL1)との共局在度は低かった(図2D~H).また,糖転移酵素の共局在度から距離関係を可視化した次元削減(MDS)のマッピングにより,糖転移酵素の相対的な局在を示すことができた(図2I).たとえば,ST3GAL3およびST3GAL4といった同じα2,3シアル酸転移酵素のアイソザイム間であっても異なる局在を示すことがわかる.これらの結果から,糖転移酵素はシス,メディアル,トランスの槽間の違いに加えて,同じ槽内にそれぞれ独自の局在を持つ可能性が考えられる.ごく最近,我々は近接依存性標識を利用して電子顕微鏡像に糖転移酵素の分布をマッピングすることを成功裏に収めている.こうしたデータからも同じゴルジ槽内に糖転移酵素が均一に存在するわけではなく,独自の局在を示すことを強く示唆している.
各々糖転移酵素が示す独自の局在は,ゴルジ装置内で糖転移酵素とほかの分子との相互作用によって規定されることが報告されている(図1).たとえば,リソソーム輸送に関わるマンノース6-リン酸含有糖鎖修飾の合成を担うGlcNAc-1-phosphotransferaseは,LYSET(TMEM251)との相互作用によってゴルジ装置に滞留し,LYSET欠損細胞では,この酵素がゴルジ装置内に存在できず,リソソーム局在タンパク質にマンノース6-リン酸含有糖鎖修飾の不全が起こる4, 5).これまでに,我々は,マトリグリカンを合成する糖転移酵素どうしが複合体を形成することを明らかにしている6).このように,糖転移酵素はトランスポーターやほかの糖転移酵素と相互作用し,ゴルジ体における局在形成を担っている可能性も考えられる.
また,電子顕微鏡像からゴルジ装置を構成する膜の厚みはシス槽からトランス槽に向けて増加することが知られている7).一方で,バイオインフォマティックス解析からはトランス側に局在する糖転移酵素は,小胞体やシスゴルジに局在する酵素と比べて膜貫通領域が長い傾向にあることが示されている8).細胞膜と糖転移酵素の膜貫通領域が相互作用するため,脂質膜の厚さに対応するように,膜内で安定する糖転移酵素の膜貫通部位の長さが規定され,各々特異的な分布を呈する可能性が想定される.
糖転移酵素の細胞質領域は,COPIコートサブユニットやCOPIアダプター(たとえばGOLPH3/Vps74)と相互作用し,それらをゴルジ装置に保持することが知られている9).たとえば,GALNT6の細胞質領域は,δ-COPの結合コンセンサス配列であるϕ-(K/R)-X-L-X-(K/R)に対応する“MRLLRR”配列が存在していることから,GALNT6はδ-COPと直接相互作用することで,シス-ゴルジ装置に局在すると考えられている10).ST3GAL4とST6GAL1は細胞質領域の配列(L-X-X-R/K)を介してGOLPH3と相互作用することが示されている11).最近では,GOLPH3と同様な機能を持つと考えられるCOPIアダプター分子も見つかっており12),各分子の使い分けが注目されている.最近我々は,B3GALT6とB4GALT1に関して,cytoplasmic, transmembrane, and stem(CTS)領域を入れ替えた組換え酵素と,それぞれの元の酵素との共局在を調べた.その結果,触媒ドメインではなくCTS領域を共有する組換え酵素の方が,元の酵素と高い共局在度を示すことが明らかになっている3).しかし,共通するCTS領域を有する酵素であっても完全には同じ局在を示さないため,触媒ドメインの影響も考えられる.これらの知見から糖転移酵素の局在は,複数の領域における相互作用によって複合的に決まる可能性が想定される.
5. 酵素の局在と糖タンパク質と輸送による糖鎖修飾制御
本稿で示したきたようにトランス側に存在すると考えられていた糖転移酵素であっても,それぞれがゴルジ装置内で異なる分布を示していることが明らかになってきた.また最近,原田らの研究により,ゴルジ体は切断や融合,変形といったダイナミックな変化を伴う小さなユニットの集合体であり,各ユニット内で糖転移酵素が独自のゾーンを形成して存在していることが示された13).このことから,ゴルジ体内での局在が従来考えられていた以上に精密に制御されていると考えられる.これらの局在を制御するメカニズムはいまだ完全には解明されていないものの,糖転移酵素の局在は,他の分子との相互作用によって決定されることが次第に明らかになりつつある.糖転移酵素と相互作用するタンパク質に関しては,近接依存性標識などの技術によって同定することが可能となってきた.また,我々は,ゴルジ体を断片化することで,糖転移酵素近傍に存在する脂質の同定に成功しつつある.これらのタンパク質や脂質を含む分子ネットワークを解明することで,糖転移酵素の局在メカニズムの全貌がみえてくると考えられる.
さらに,このような糖転移酵素の緻密な分布は,糖鎖修飾の制御にも重要な役割を果たしている可能性がある.我々は以前に小胞体とゴルジ体間の輸送を担うカーゴ受容体が認識する10残基の配列(パスポート配列)を発見していたが14),ごく最近,本配列をエリスロポエチンなどのモデル糖タンパク質に付加するとシアル酸修飾,ガラクトース修飾が亢進することを見いだした15).さらには,本パスポート配列を付加したエリスロポエチンはゴルジ体内の分布が変化することも見いだしている.このことは,糖タンパク質の輸送と糖転移酵素の限定的な局在によって,基質特異的な糖鎖修飾が制御されている可能性を示唆すものである.
古くから研究されているゴルジ体における糖鎖修飾のメカニズムが,新たな局面を迎えつつある.従来,ゴルジ体の糖転移酵素は比較的単純な分布や機能を持つと考えられていたが,近年の研究で示されているように,これらの酵素はゴルジ体内で非常に緻密に制御された分布を持ち,特定の基質と相互作用しながら精巧な糖鎖修飾を行っている可能性が高まっている.さらに,我々の発見した「パスポート配列」など,基質特異的な配列が糖鎖修飾の制御に寄与していることが明らかになりつつあり,これは基質の輸送経路や糖転移酵素の詳細な局在が糖鎖修飾に大きく影響を与えることを示唆している.今後,糖転移酵素の局在メカニズムや基質の特異的な糖鎖修飾の理解がさらに進むことで,ゴルジ体における糖鎖修飾の全体像が解明され,生化学,糖鎖生物学,細胞生物学などの分野において新たな展開が期待される.