2. ヒドロキシプロリンガラクトシル化酵素(HPGT)の欠損株を用いたアラビノガラクタンプロテイン(AGP)の機能探索
1)ヒドロキシプロリンガラクトシル化酵素
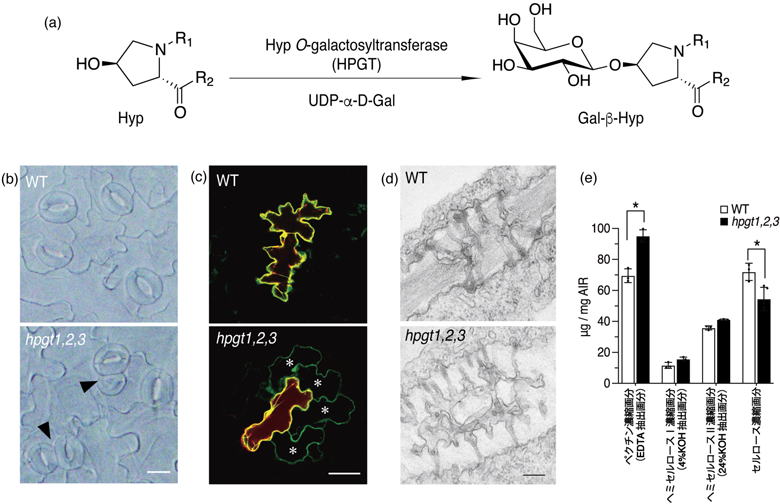
タンパク質の糖鎖修飾は真核生物のすべてと細菌・古細菌の一部でもみられる普遍的な翻訳後修飾であり,特に真核生物ではタンパク質の半分以上が糖タンパク質であると考えられている.その一方,糖鎖修飾は構成する単糖や結合様式などにおいて生物種による多様性が非常に高いことも特徴であり,植物特異的な糖修飾として,ヒドロキシプロリン(Hyp)残基へのO結合型糖鎖修飾が知られている.プロリン残基の水酸化は動物のコラーゲンでも多くみられる翻訳後修飾であるが,このHyp残基への糖付加は動物では見いだされていない.植物のHyp残基にはアラビノースあるいはガラクトースが付加するが,Hyp残基へのガラクトース付加は,ヒドロキシプロリンガラクトシル化酵素(hydroxyproline O-galactosyltransferase:HPGT)4)とそのホモログであるGALT5)によって行われる(図1a).
Hypガラクトシル化修飾は,主に植物固有のプロテオグリカンであるアラビノガラクタンプロテイン(arabinogalactan-protein:AGP)でみられる翻訳後修飾である.AGPはモデル植物であるシロイヌナズナでは151個もの遺伝子からなるファミリーであり,Ala-Hyp, Ser-Hyp, Thr-Hypなどの2アミノ酸の繰り返しモチーフを持つコアプロテインのHyp残基に,アラビノガラクタン糖鎖が付加している6).アラビノガラクタン糖鎖は,β-1,3-ガラクタン主鎖に,β-1,6-ガラクタン側鎖が枝分かれし,さらにその側鎖にL-アラビノース,L-フコース,D-グルクロン酸などの多様な糖が結合した,非常に複雑な構造を持つ.AGPは,一部のAGP欠損株の解析や,AGP糖鎖に結合して沈殿を形成するヤリブ試薬7)投与による機能阻害実験等から,細胞伸長・細胞分裂・分化・花粉管伸長・プログラム細胞死・防御応答・情報伝達など,植物の成長,発達に重要なプロセスの多くに関わっていると考えられているが,重複性の高さゆえ個々のAGP欠損株で表現型が観察されるものは全体のごく一部である.また,ヤリブ試薬は植物体の内部までは浸透しないため,投与で観察される影響は限定的である.
そこで,筆者らはAGPの糖鎖修飾を抑制することで全AGPの機能を低下させた株を作製し,その表現型からAGPの機能探索を試みた.AGPの糖鎖修飾は最初のガラクトースがコアペプチドのHyp残基へ付加されることから開始されるため,このガラクトシル化酵素が存在しなければAGPの糖鎖修飾自体が起こらない.先に述べたようにAGPのHyp残基にガラクトースを付加する活性が確認されている糖転移酵素にはHPGT(HPGT1, HPGT2, HPGT3)4)と,系統樹的に近いが異なるクレードに属するGALT(GALT2, GALT3, GALT4, GALT5, GALT6)の二つのグループが存在する5).筆者らはこれまでにAGPのコアペプチド配列を元にしたペプチド断片を用いたアフィニティー精製によって,このHPGTファミリーをシロイヌナズナの培養細胞から単離・同定した.HPGT三重欠損株hpgt1,2,3はライフサイクルは維持しつつも,AGP全体の糖鎖修飾が野生株の10分の1にまで減少し,矮化や側根・根毛の伸長,根の皮層細胞の肥大や稔性の低下など栄養成長,生殖成長のどちらにおいても多面的な表現型の変化が観察された.したがって,このhpgt1,2,3三重欠損株ではAGPの機能が十分に抑制されていると判断し,AGPの新規機能を探索するため,これまでに報告のない部位や組織を中心に詳細な表現型解析を行った.
2)hpgt1,2,3三重欠損株の新規表現型探索
詳細なhpgt1,2,3三重欠損株の表現型探索を行った結果,通常隣り合わないように形成される気孔が,複数個まとまってクラスターとなっている割合が欠損株の子葉で増加していることを見いだした(図1b).気孔のクラスター化の要因の一つに細胞間輸送の制御異常が報告されている.植物では,原形質連絡と呼ばれる細胞間をつなぐ管状構造を通じて細胞間の分子輸送(シンプラスト輸送)が行われるが,動物細胞のギャップ結合と異なり,イオンや小分子だけでなく,mRNAやタンパク質など比較的大きな分子も輸送するなど,植物の物質輸送や細胞間情報伝達の一翼を担っていることが知られている8).hpgt1,2,3三重欠損株においてこのシンプラスト輸送に変化があるかを調べるため,パーティクルボンバードメント法により蛍光タンパク質を葉の表皮細胞に一過性発現させ,蛍光タンパク質の拡散を比較した.その結果,hpgt1,2,3三重欠損株では野生株と比較して発現させた細胞からより広範囲の細胞に広がる様子がみられ,シンプラスト輸送が亢進していることが明らかになった(図1c).さらに,透過型電子顕微鏡による原形質連絡の詳細な観察では,hpgt1,2,3三重欠損株において原形質連絡が複雑に枝分れし,さらに中央部分に非常に大きい空間を持つものの割合が大幅に増加していた(図1d).これらの結果から,AGPは原形質連絡の正常な形成に重要であり,hpgt1,2,3三重欠損株における気孔のクラスター化の原因は,原形質連絡の構造の変化によりシンプラスト輸送が亢進し,適時適所で機能するべき気孔の形成制御因子の局在が乱れたためであると考えられた.また,hpgt1,2,3三重欠損株の細胞壁ではセルロースの割合が減少している一方,細胞壁の可塑性を制御するペクチンの割合が増加しており(図1e),AGP糖鎖が細胞壁組成に影響を与えることも示された9).
3. チロシン硫酸化酵素(TPST)の欠損株を用いたペプチドホルモンPSYの解析
1)チロシン硫酸化酵素(TPST)
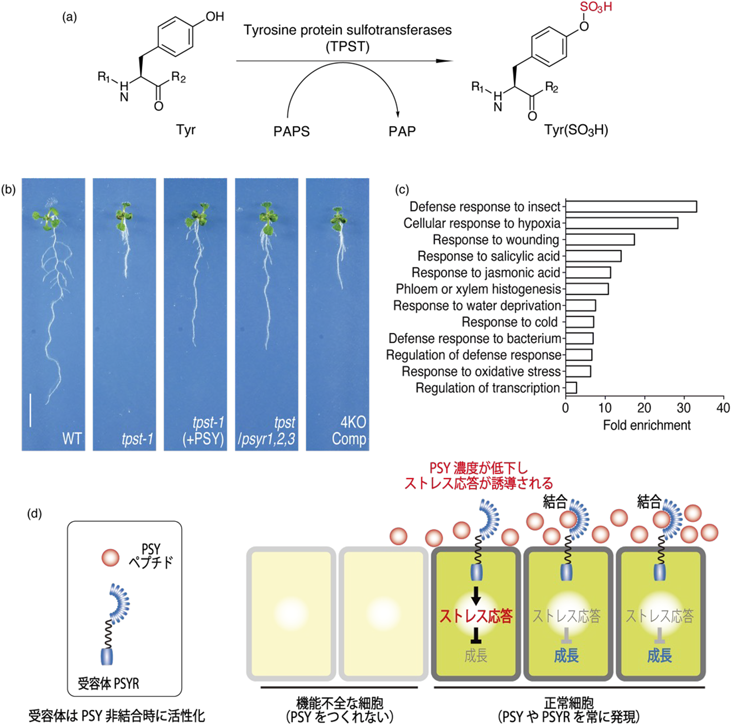
チロシンの硫酸化は真核生物の分泌型ペプチドやタンパク質でしばしばみられる翻訳後修飾であり,チロシン硫酸化酵素(tyrosine protein sulfotransferase:TPST)によって硫酸基供与基質である3′-phosphoadenosine-5′-phosphosulfate(PAPS)からチロシンへ硫酸基が転移付加される(図2a).TPSTは全身的に発現するゴルジ体局在の一回膜貫通型タンパク質であるが,動物のTPSTはC末端が内腔側になるII型膜貫通タンパク質であるのに対し10),シロイヌナズナのTPSTはN末端が内腔側になるI型膜貫通タンパク質である.アミノ酸配列も動物のものとまったく異なることから,動物と植物は進化的に独立してTPSTを獲得したと考えられる.シロイヌナズナのTPSTは2009年に筆者らの研究グループがシロイヌナズナ培養細胞の膜画分からチロシン硫酸化ペプチドの部分配列を用いたアフィニティー精製によって単離・同定した11).シロイヌナズナはTPSTを1遺伝子しか持たないため,単一遺伝子変異ですべてのチロシン硫酸化修飾を持つペプチドやタンパク質の機能を失わせることができる.TPST欠損株(tpst-1)は全体的に小さくなるが,特に根端メリステム活性や細胞伸長活性の低下が顕著であった.筆者らの研究グループでは以前このtpst-1の表現型解析から,根端メリステムにおける細胞分裂活性を制御するペプチドホルモンRGFファミリーを発見している12).最近,このチロシン硫酸化酵素欠損株tpst-1を再び用いて,これまでペプチドホルモンの成熟型構造やその受容体は明らかとなっていたにもかかわらず,生理機能が不明であったチロシン硫酸化ペプチドホルモンPSYファミリーとその受容体PSYRの機能解析を行った.
2)チロシン硫酸化ペプチドホルモンPSYファミリー
PSY(PLANT PEPTIDE CONTAINING SULFATED TYROSINE)ファミリーは2007年にシロイヌナズナ培養細胞の培養液から同定したチロシン硫酸化ペプチドである13).植物全体で恒常的に発現しており,過剰発現株では植物が大きくなるものの,これまで本質的な生理機能は不明であった.PSYファミリーはシロイヌナズナでは9個の遺伝子からなり,すべての遺伝子を欠損させることは困難であった.しかし,PSYファミリーはチロシン硫酸化修飾が存在し,この修飾が活性に必須であることから,チロシン硫酸化酵素欠損株tpst-1をPSYファミリー全体の機能欠損株として利用した.tpst-1変異株にPSYペプチドを合成して投与することで,投与したペプチドの効果だけを明確にみることができる.その結果,PSY投与により細胞が大きくなり,根や地上部が大きくなったことから,PSYが全身の細胞に対して成長を促進する作用を持つことが明らかとなった.次に,PSYの受容体PSYRはシロイヌナズナで3個存在するが,PSYペプチド投与の影響が,これらの受容体の欠損で失われることを確認するため,tpst-1に加えてさらに三つの受容体を欠損させた四重変異株を作製した.これまでに知られている植物のペプチドホルモン受容体は,リガンドと結合することで活性化するため,受容体の欠損はペプチドの欠損と類似した表現型を示す.そのため,この四重変異株もtpst-1と同様に成長が抑制される表現型を示すと予想していたのだが,意外にもtpst-1にPSYペプチドを投与したときと同程度の成長促進が観察された.しかも,この四重変異株にPSYR受容体遺伝子を再導入すると,tpst-1程度まで成長が抑制されたのである(図2b).これはペプチドが受容体と結合することで受容体が活性化し,成長を促進するという従来の作用機構ではなく,PSYR受容体はリガンド非存在下では活性化して成長を抑制しており,PSYペプチドが結合することでその活性が抑制されるという新たな作用機構の存在を示している.
PSYR受容体の本質的な機能を明らかにするため,tpst-1にPSYペプチドを投与したときと,tpst-1株中でさらに受容体を欠損させたときの遺伝子発現変動を比較すると,種々のストレス応答遺伝子が共通して減少していることが明らかとなった(図2c).これは,受容体PSYRはPSYペプチドが存在しないときにストレス応答を促進しており,PSYペプチドを受容するとそれが抑制されることを意味している.植物のエネルギー使用において,成長とストレス応答はトレードオフの関係にあり,植物がさまざまなストレスにさらされると,その対応にエネルギーが使われるため成長が抑制される.PSYペプチドの投与やPSYRの欠損で細胞伸長が促進されたのは,ストレス応答が抑制され,それに伴って成長が促進された結果であると考えられた.実際,受容体の三重変異株psyr1,2,3では成長が促進されるものの,さまざまなストレスに対する耐性が低下していることが確認された.したがって,PSYRがストレス応答に必要であり,PSYファミリーとその受容体PSYRが成長とストレス応答のトレードオフの制御に関わることが明らかとなった14).
これまで知られているペプチドホルモンの作用機構とは逆の,リガンドと結合することで受容体の活性を抑えるというPSY-PSYRシグナルの仕組みにはどのようなメリットがあるのだろうか?さまざまな状況証拠から筆者らは以下のようなモデルを考えている.PSYもPSYRも全身的に恒常的に発現していることから,通常時はPSYペプチドが常に受容体に結合し,ストレス応答が抑制されて成長が促進されている.しかし一部の細胞が重大なダメージを受けたとき,その細胞群はPSYペプチドを生産できなくなる.その結果,ダメージを受けた細胞の周辺でPSYペプチドの濃度が減少し,PSYRが活性化する(図2d).この仕組みを使えば,全身の成長に与える影響を最小限にしつつ,必要な部分でのみ速やかにストレス応答を誘導することが可能になる.植物は動物のような高度な神経系などは持たないが,シンプルな仕組みで変動環境に適切に適応しているのである.
植物のタンパク質・ペプチドは機能的冗長性の高い多数の遺伝子からなるファミリーであることが多く,解析に工夫が必要となる場合が少なくない.翻訳後修飾酵素の欠損株に着目した手法は,翻訳後修飾が活性に重要である一群の分泌型タンパク質・ペプチドファミリーにおいて非常に有用なアプローチであり,本稿で紹介したHPGT欠損株を用いたAGPの機能探索のように,翻訳後修飾酵素欠損株の表現型に着目して,基質ペプチド・タンパク質がどこで機能しているかを探し出すこともできるし,TPST欠損株を用いたPSYペプチドの機能解析のように,翻訳後修飾酵素欠損株を用いて個々の翻訳後修飾ペプチド・タンパク質の本質的な機能を明らかにすることもできる.
現在筆者らは細胞壁糖タンパク質であるエクステンシンや,一部のペプチドホルモンでみられる翻訳後修飾であるHyp残基へのアラビノース付加を行うヒドロキシプロリンアラビノシル化酵素(hydroxyproline O-arabinosyltransferase:HPAT)15)についても解析を進めている.翻訳後修飾酵素欠損株を用いた基質タンパク質・ペプチドファミリーの機能解析をさらに広げていきたい.