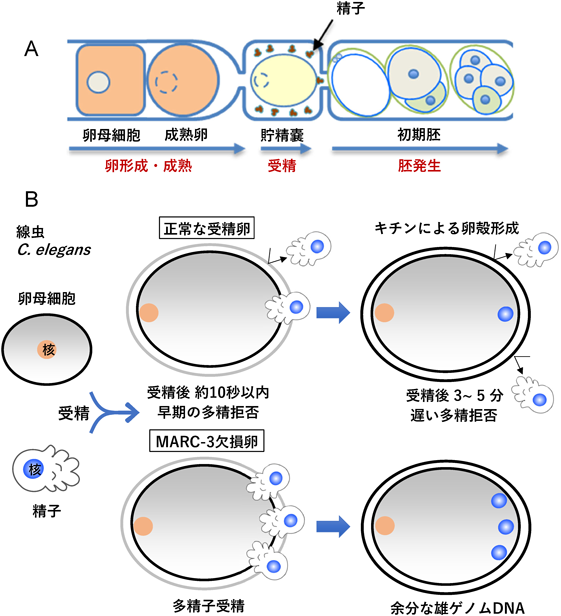
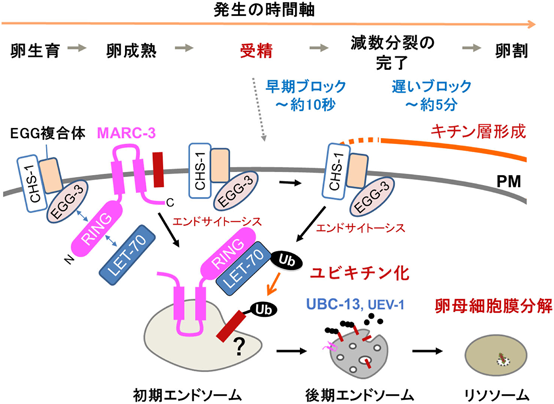
RING-CH型ユビキチンリガーゼMARC-3の解析からみえてきた早期多精拒否機構Analysis of RING-CH type ubiquitin ligase MARC-3 reveals a mechanism for the fast polyspermy block
群馬大学生体調節研究所細胞構造分野Lab of Mol. Traffic, Institute for Molecular and Cellular Regulation, Gunma University ◇ 〒371–8512 群馬県前橋市昭和町3–39–15 ◇ 3–39–15 Showa-machi, Maebashi, Gunma 371–8512, Japan