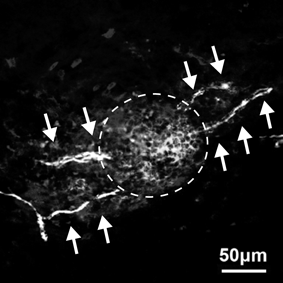
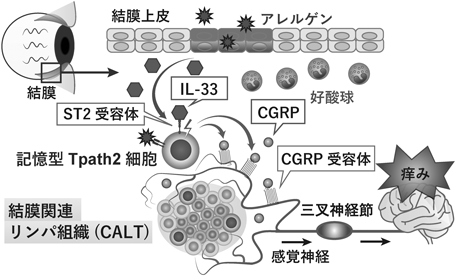
IL-33-ST2-CGRP経路を介した記憶型Tpath2細胞による「免疫–神経連関」と痒みの病態形成機構Immune–neuronal interaction in the pathogenesis of itch by memory-type pathogenic Th2 (Tpath2) cells via the IL-33-ST2-CGRP pathway
1 千葉大学大学院医学研究院免疫発生学Department of Immunology, Graduate School of Medicine, Chiba University ◇ 〒260–8670 千葉市中央区亥鼻1–8–1 ◇ 1–8–1 Inohana, Chuo-ku, Chiba-shi, Chiba 260–8670, Japan
2 順天堂大学医学部附属浦安病院眼科Department of Ophthalmology, Juntendo University Urayasu Hospital ◇ 〒279–0021 千葉県浦安市富岡2–1–1 ◇ 2–1–1 Tomioka, Urayasu-shi, Chiba 279–0021, Japan