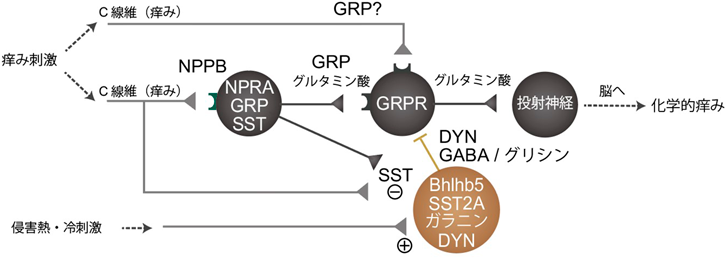
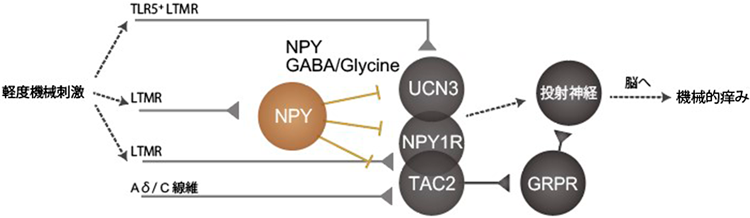
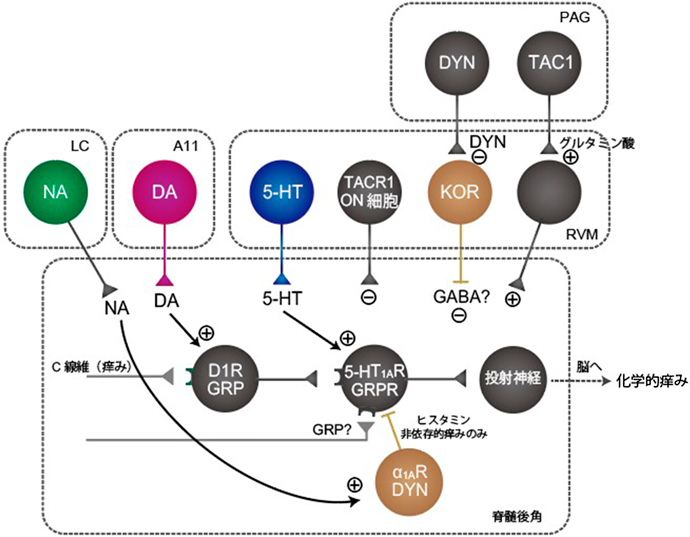
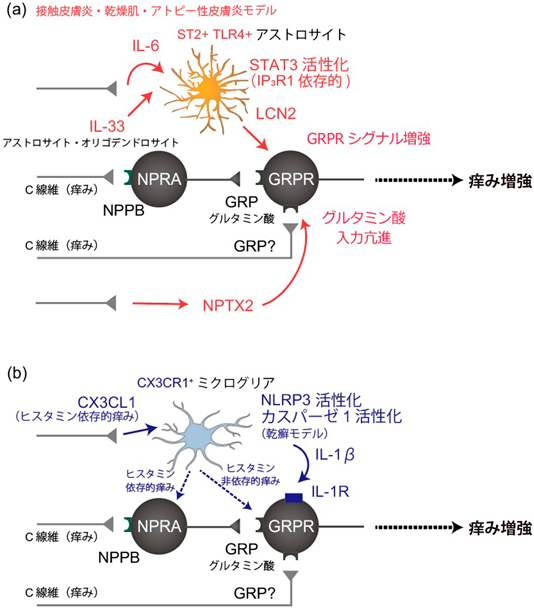
脊髄における痒みシグナル調節機構Regulatory mechanisms of itch signaling in the spinal cord
1 順天堂大学薬学部薬理学分野Department of Molecular and Systems Pharmacology, Faculty of Pharmacy, Juntendo University ◇ 〒279–0013 千葉県浦安市日の出6–8–1 ◇ 6–8–1 Hinode, Urayasu-shi, Chiba 279–0013, Japan
2 順天堂大学大学院医学研究科環境医学研究所順天堂かゆみ研究センターJuntendo Itch Research Center (JIRC), Institute for Environmental and Gender Specific Medicine, Juntendo Univ. Graduate School of Medicine ◇ 〒279–0021 千葉県浦安市富岡2–1–1 ◇ 2–1–1 Tomioka Urayasu-shi, Chiba 279–0021, Japan
3 九州大学大学院薬学研究院薬理学分野Department of Molecular and Systems Pharmacology, Graduate School of Pharmaceutical Sciences, Kyushu University ◇ 〒812–8582 福岡県福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi-ku, Fukuoka 812–8582, Japan