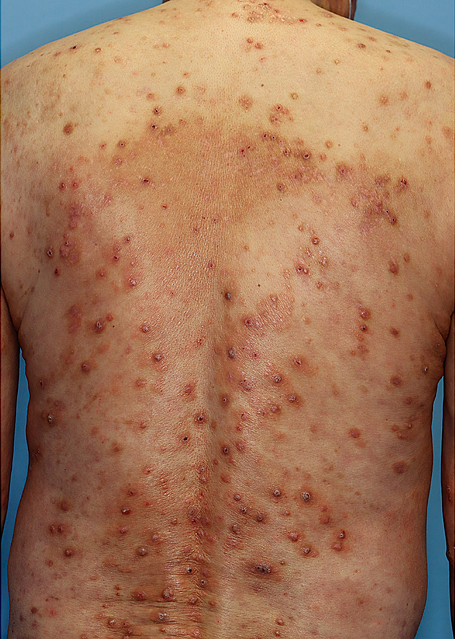
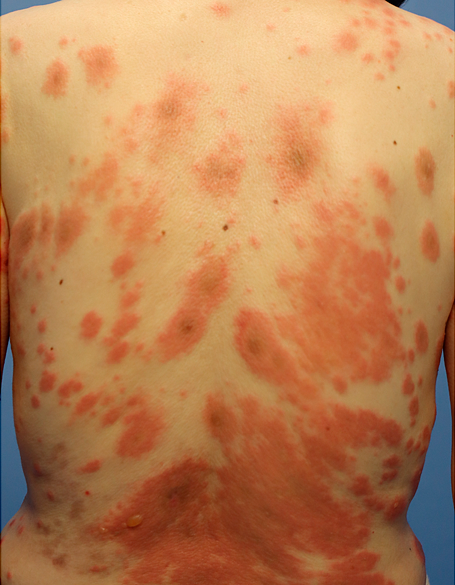
痒みを伴う皮膚疾患は多岐にわたるが,アトピー性皮膚炎はその中でも最も強い痒みを伴う疾患の一つである.そして,痒みはアトピー性皮膚炎患者の最も辛い症状である.痒みによる苦痛はしばしば耐えがたいものであり,睡眠不足,集中力・作業パフォーマンスの低下など,患者QOL(quality of life)は痒みにより大きく低下する.したがって,痒みのコントロールはアトピー性皮膚炎治療においてきわめて重要な要素となる.しかし,アトピー性皮膚炎の痒みの本態は長年不明であり,そのコントロールは必ずしも容易ではなかった.
皮膚科の実臨床では,痒みを伴う皮膚疾患に対し多くの場合ステロイド外用剤と抗ヒスタミン薬が用いられる.痒みについてこれらが著効する皮膚疾患も多いが,アトピー性皮膚炎の場合,ステロイド外用剤は比較的効果的に痒みを抑制するが,抗ヒスタミン薬の痒み抑制効果は限定的であった.したがって,ヒスタミン以外の何らかの痒みメディエーターがアトピー性皮膚炎の痒みに関わっていると想定されていたが,その本態は不明であった.
しかし近年の基礎研究と生物学的製剤の発展に伴い,アトピー性皮膚炎の痒みメディエーターの理解は大きく進歩した.特に,IL-4, IL-13, IL-31を代表とするタイプ2サイトカインが,アトピー性皮膚炎の痒みに深く関わっていることが明らかとなってきた.これらサイトカインに対する生物学的製剤はいずれもアトピー性皮膚炎の痒みを効果的に抑制し,臨床応用されている.さらに,それらサイトカインからの細胞内シグナルを阻害するJAK阻害薬もアトピー性皮膚炎治療に適用され,痒みコントロールに大きく貢献している.
本稿では,JAK阻害薬によるアトピー性皮膚炎の痒み制御について,主に臨床的観点から紹介する.まずアトピー性皮膚炎の基本的病態を説明し,その後各種経口JAK阻害薬の特徴,実臨床におけるJAK阻害薬の位置づけについて解説する.
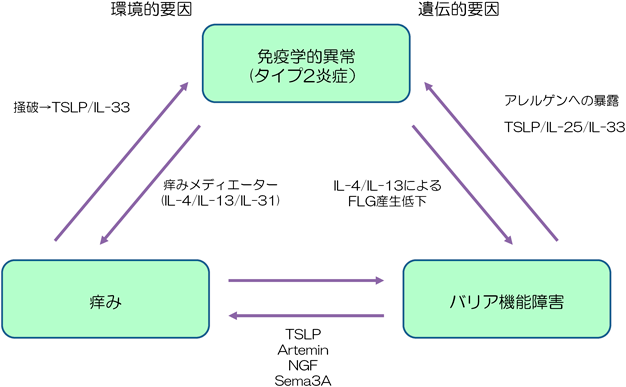
アトピー性皮膚炎は臨床的には慢性的に続く皮膚炎症,乾燥肌,痒み,の三つをその大きな特徴とする(図1).病態についても,免疫学的異常,バリア機能異常,そう痒,の三つの観点から捉えることができる1)(図2).近年はこの中でも特に「免疫学的異常」の重要性がクローズアップされている.またその内容も「タイプ2炎症」という概念で捉えられている2).
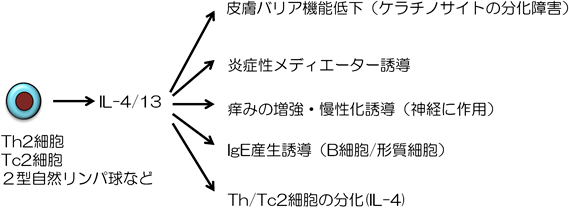
タイプ2炎症とは「タイプ2サイトカイン」と呼称される一群のサイトカインによって誘導される炎症を指す.タイプ2サイトカインの中でも,特にIL-4, IL-13, IL-31がアトピー性皮膚炎において中心的な役割を果たしている.皮膚では主にTh2細胞やTc2細胞などT細胞が主要な産生細胞であるが,自然リンパ球(2型自然リンパ球),好塩基球,肥満細胞など,自然免疫系の細胞からも産生される.
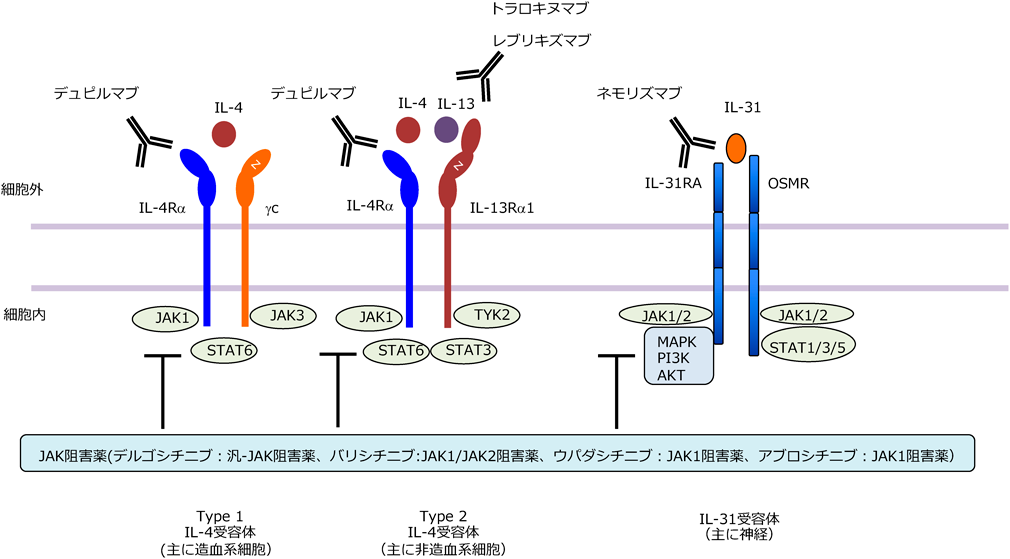
IL-4とIL-13の作用メカニズムであるが,これらは共通の受容体(2型IL-4受容体)を介し,その生理活性を発揮する(図3).若干の違いはあるものの,IL-4とIL-13はほぼ同様の作用を有する.2型IL-4受容体は,表皮角化細胞など主に非血球系の細胞に発現している.IL-4/IL-13が表皮角化細胞の2型IL-4受容体に結合すると,ヤーヌスキナーゼ(Janus kinaze:JAK)と呼ばれるシグナル伝達分子の活性化を介してCCL22やCCL26などさまざまな炎症性サイトカイン/ケモカインを誘導し,Th2細胞などの炎症細胞浸潤を促進すると考えられる.また,IL-4/IL-13は表皮角化細胞の分化障害,フィラグリン産生低下,抗菌ペプチド産生低下などをもたらす(図4).表皮角化細胞の分化が障害されると,皮膚バリア機能に重要な役割を果たす角質層の形成不全につながる.またフィラグリンは天然保湿因子の元となり,保湿・バリア機能維持に重要な役割を果たす.したがってIL-4/IL-13によりこれらが障害されると,結果的に皮膚バリア機能低下や皮膚細菌叢の変化を誘導する.バリア機能の低下や皮膚細菌叢の変化は,外界からの抗原侵入を容易とし,さらにIL-4/IL-13の産生増強に働きうる.また2型IL-4受容体は感覚神経にも発現しているため,IL-4/IL-13は神経にも作用する.IL-4/IL-13が感覚神経に作用すると,ヒスタミンや,後述するIL-31などの痒みメディエーターからの痒みシグナルの増強や遷延化を誘導し,痒みの慢性化に強力に関わる3)(痒みmodulatorとしての役割).なおアトピー性皮膚炎病変部ではIL-4, IL-13はともに産生されているものの,IL-13の発現が強く確認されており,皮膚局所での作用は主にIL-13と考えられている(図2).またIL-13は痒みシグナルの増強のみならず,それ自体も直接的に神経に作用して痒みを誘導する可能性も示唆されている.一方IL-4は2型IL-4受容体に加え,Type 1 IL-4受容体を介してその生理作用を発揮する.Type 1 IL-4受容体は主にリンパ球など血球系細胞に発現している.IL-4はリンパ節においてナイーブT細胞に作用し,Th2/Tc2細胞への分化に必須の役割を果たす.したがってIL-4は皮膚局所だけではなく,リンパ節においてもアトピー性皮膚炎病態形成促進的に作用していると考えられる.
IL-4/IL-13の痒み誘導作用は他の痒みメディエーターからの痒みシグナル増強が主体であるのに対し,IL-31はそれ自身が強力な痒みメディエーターとして作用し,アトピー性皮膚炎病態の痒みに深く関わっている.IL-31は主にTh2細胞から産生される.IL-31の受容体[IL-31RAとOSMR(oncostatin M receptor)の二量体]は皮膚の一部の感覚神経に発現しており,直接的に痒みを誘導すると考えられている.IL-31の細胞内シグナル伝達にもJAKが関わっている.その他,IL-33やTSLPといったサイトカインも痒みメディエーターあるいはmodulatorとして機能することが基礎的知見から報告されている.しかし,これらを標的とした生物学的製剤はアトピー性皮膚炎に対し治験が行われたものの十分な症状改善効果が得られず,実臨床での応用には至っていない.したがって,これらのサイトカインが実際アトピー性皮膚炎病態でどの程度,痒みを含めた病態形成に関与しているかは今のところ不明である.
2024年7月現在,4種類の生物学的製剤がアトピー性皮膚炎に保険適用になっている.2018年に発売されたデュピルマブ(商品名デュピクセント)は抗IL-4Rα抗体であり,Type 1 IL-4受容体,2型IL-4受容体いずれの受容体にも作用するため,IL-4, IL-13両者のシグナルを阻害しその治療効果を発揮する.2022年には抗IL-31RA抗体であるネモリズマブ(商品名ミチーガ)が発売された.同2022年には抗IL-13抗体であるトラロキヌマブ(商品名アドトラーザ),2024年には同じく抗IL-13抗体であるレブリキズマブ(商品名イブグリース)が承認され,臨床応用されている.このようにアトピー性皮膚炎の治療はサイトカインあるいはサイトカイン受容体をターゲットとした新薬が続々と登場している.これらはいずれも皮下注射製剤であり,2週間ごと,あるいは4週間ごとに投与する.いずれの薬剤も高い治療効果を発揮し,また副作用も結膜炎が一定頻度で生じるものの(デュピルマブ,トラロキヌマブ,レブリキズマブ),その他重篤なものはほとんどなく,安全性も高い.投与にあたり一定の重症度基準を満たす必要はあるが,事前のスクリーニング検査は必要とされない.
多くのサイトカインの受容体の下流の細胞内シグナル伝達には,JAKと呼ばれる細胞内シグナル伝達分子が介在する.JAKにはJAK1, JAK2, JAK3, Tyk2の4種類が存在するが(JAKファミリー),上述したタイプ2サイトカインであるIL-4, IL-13,そしてIL-31においても,そのシグナル伝達に各種JAKを介する.したがって,JAKの機能を阻害すればこれらタイプ2サイトカインのシグナル伝達の阻害が可能となる.
現在JAK阻害薬は外用剤と経口薬の2種類が存在する.外用剤としては本邦ではデルゴシチニブ軟膏(汎JAK阻害薬)が,経口JAK阻害薬としてはバリシチニブ(JAK1/JAK2選択的阻害薬),ウパダシチニブ(JAK1選択的阻害薬),アブロシチニブ(JAK1選択的阻害薬)の3種類が臨床的に使用可能となっている(図3).それぞれのJAK阻害薬は,JAKファミリーのどのJAKを優先的に阻害するかで特徴づけられる.外用JAK阻害薬は0.5%と0.25%のデルコシチニブ製剤が発売されている.いずれの濃度も小児でも使用が可能である.軽度の毛包炎が生じることがあるものの,重篤な有害事象は報告されておらず,また刺激感もほとんどないため使用しやすい薬剤である.
一方経口JAK阻害薬は,一定の重症度基準を満たし(既存治療を適切に行っているにもかかわらず中等症以上の症状が続く場合),また感染症等のスクリーニング検査で問題がない中等症から重症のアトピー性皮膚炎患者への治療が認められている4, 5).2024年7月現在,バリシチニブは2歳以上から,ウパダシチニブ,アブロシチニブは12歳以上から使用可能となっている.JAK阻害薬はいずれも生物学的製剤に匹敵する高い治療効果を発揮する.臨床的に特に注目されている点として,生物学的製剤と比べ比較的早い痒み改善効果があげられる4).したがって,即効性を期待する症例においては,有効な治療選択肢である(表1).
表1 アトピー性皮膚炎治療における経口JAK阻害薬の好適応例| ・中等症~重症例 | |
| ・患者が希望する場合 | |
| ・即効性を希望する場合 | |
| ・注射不適な重症例 | |
| ・生物学的製剤治療反応不良例 | |
| ・生物学的製剤副作用のため継続困難例 | |
| ・非高齢者(小児) | (私見) |
一方で,JAKはタイプ2サイトカイン以外のさまざまなサイトカインのシグナル伝達にも関わっているため,JAK阻害薬によりタイプ2サイトカイン以外のサイトカイン機能も阻害される.したがって,免疫抑制などの副作用の懸念(帯状疱疹の発症など)は生物学的製剤より高い.実際,高齢者になると有害事象として帯状疱疹の発生数が若干上昇している.また,腎機能障害や肝機能障害のある患者においては使用に注意が必要である.使用前の血液検査等の検査は必須であり,また使用後も定期的な血液検査が推奨されている(表2).また高額な薬剤であり,患者の経済的状況および医療経済に対する負担は無視できない(表3).しかし,経口剤であることから患者にとっての利便性は高く,重要な治療選択肢となっている.
表2 経口JAK阻害薬の長所と短所| 長所 | ・手軽 | |
| ・痛くない | |
| ・即効性 | |
| ・用量,内服期間等を微調整しやすい | |
| 短所 | ・高額 | |
| ・感染症(特に帯状疱疹・単純疱疹など)に注意 | |
| ・投与前・投与後の検査の必要性 | (私見) |
表3 経口JAK阻害薬の薬価薬剤名
(商品名) | バリシチニブ
(オルミエント®) | ウパダシチニブ
(リンヴォック®) | アブロシチニブ
(サイバインコ®) |
|---|
| 薬価(2024年7月現在) | 1357円(1 mg) | 2595円(7.5 mg) | 2587円(50 mg) |
| 2706円(2 mg) | 5089円(15 mg) | 5044円(100 mg) |
| 5275円(4 mg) | 7352円(30 mg) | 7566円(200 mg) |
| 用法・用量 | 1~4 mg/日 | 15~30 mg/日 | 100~200 mg/日 |
| 1か月の薬価 | 約147,560円
(4 mg/日の場合) | 約205,000円
(30 mg/日の場合) | 約211,000円
(200 mg/日の場合) |
5. JAK阻害薬が効く可能性のある痒みと皮膚疾患
現在皮膚科領域でのJAK阻害薬はアトピー性皮膚炎が主となっている.しかし,タイプ2サイトカインをターゲットとした生物学的製剤は徐々にその適用を広げている.それら生物学的製剤が効果的な痒み・皮膚疾患では,理論上はJAK阻害薬も効果的である可能性がある.以下は,JAK阻害薬による痒み抑制効果が直接的には示されていない,あるいは臨床応用(保険適用)されていないが,将来的に応用される可能性がある疾患を紹介する.
結節性痒疹は,きわめて強いそう痒を伴う結節が全身に多発する難治性皮膚疾患である(図5).病態は不明な点が多いが,病変局所ではタイプ2サイトカインが上昇しており,アトピー性皮膚炎と近いサイトカイン環境と考えられている.タイプ2サイトカインの中でも,特にIL-31の上昇が強いと報告されている6).2024年7月現在,デュピルマブ(抗IL-4Rα抗体),ネモリズマブ(抗IL-31RA抗体)が結節性痒疹に保険適用になり,従来薬には認められなかった高いそう痒抑制効果・治療効果を発揮している.JAK阻害薬は現時点では結節性痒疹に保険適用となっていないものの,サイトカインシグナル伝達メカニズムを考えると,治療効果が十分期待される.実際,症例報告ベースではあるが,その有効性が報告されている.第二相の治験も進行中であり7, 8),JAK阻害薬は今後結節性痒疹の新たな治療選択肢となる可能性も考えられる.
類天疱瘡は,自己免疫性水疱症の一種である.自己免疫性水疱症の中では最も頻度が高く,比較的高齢者に多く発生する(図6).表皮基底膜の構成分子に対する自己抗体(抗BP180抗体)が,病態形成の主体となり水疱を形成する.その臨床的特徴の一つが,強い痒みである.痒みの原因は不明であるが,病変局所では好酸球浸潤が目立ち,タイプ2サイトカインが病態形成・痒み誘導に関与している可能性が考えられている.従来,類天疱瘡の治療の主体はステロイドの内服治療であった.しかし近年,デュピルマブによる治療効果・痒み改善効果を示す症例報告が相次いでおり,デュピルマブによる治験も近年スタートしている状態である9).一方,JAK阻害薬による治療効果・痒み改善効果についても,複数の症例報告が存在する10).高齢者に多いという疾患の特性と,JAK阻害薬による免疫抑制の副作用を考えるとその臨床応用は困難が予想されるが,類天疱瘡の痒みにおいてもJAKシグナルが関与している可能性は高いと考えられる.
蕁麻疹は主に肥満細胞の脱顆粒を病態の基本とする真皮の一過性浮腫であり,臨床的には膨疹(蚊に刺されたような膨らんだ皮疹)を形成する.強い痒みを特徴とする.この痒みには抗ヒスタミン薬が一般に有効であり,タイプ2サイトカインの関与はそれほど大きいものではないが,一部の難治性の蕁麻疹には近年デュピルマブが保険適用され,治療効果を発揮している.その作用点は必ずしも明らかではないが,IL-4/IL-13シグナルが病態の一部,痒み形成の一部に関与していると考えられる.実際,JAK阻害薬による治験も進行しており11),難治性の蕁麻疹に対する将来的な治療選択肢となる可能性も期待される.
痒みメディエーターの種類は現在わかっているだけで40種類を超え12),痒みは多彩な因子により誘導されていると考えられる.一方で多くの炎症性皮膚疾患ではサイトカインがその病態の主軸となっており,炎症性皮膚疾患においては痒みについてもサイトカインが関わっている可能性が高い.その中でも,アトピー性皮膚炎はJAK阻害薬が適応となっている炎症性皮膚疾患であり,JAK阻害薬により痒みは強力に制御される.アトピー性皮膚炎以外の炎症性皮膚疾患においても,JAK阻害薬は理論的には炎症と痒みを効率的に抑制する可能性がある.しかし一方で,その効果はいまだ不明な点が多く,またJAK阻害に伴う免疫抑制の問題や,医療経済的観点からもその適応は慎重に検証・議論される必要があるが,痒み治療のターゲットとしては,JAKの制御はその有望な一つと考えられる.
引用文献References
1) Nomura, T., Honda, T., & Kabashima, K. (2018) Multipolarity of cytokine axes in the pathogenesis of atopic dermatitis in terms of age, race, species, disease stage and biomarkers. Int. Immunol., 30, 419–428.
2) Honda, T. & Kabashima, K. (2020) Reconciling innate and acquired immunity in atopic dermatitis. J. Allergy Clin. Immunol., 145, 1136–1137.
3) Oetjen, L.K., Mack, M.R., Feng, J., Whelan, T.M., Niu, H., Guo, C.J., Chen, S., Trier, A.M., Xu, A.Z., Tripathi, S.V., et al. (2017) Sensory neurons co-opt classical immune signaling pathways to mediate chronic itch. Cell, 171, 217–228.e13.
4) Kamata, M. & Tada, Y. (2023) Optimal use of jak inhibitors and biologics for atopic dermatitis on the basis of the current evidence. JID Innov., 3, 100195.
5) Mikhaylov, D., Ungar, B., Renert-Yuval, Y., & Guttman-Yassky, E. (2023) Oral Janus kinase inhibitors for atopic dermatitis. Ann. Allergy Asthma Immunol., 130, 577–592.
6) Sonkoly, E., Muller, A., Lauerma, A.I., Pivarcsi, A., Soto, H., Kemeny, L., Alenius, H., Dieu-Nosjean, M.C., Meller, S., Rieker, J., et al. (2006) IL-31: A new link between T cells and pruritus in atopic skin inflammation. J. Allergy Clin. Immunol., 117, 411–417.
7) Han, Y., Woo, Y.R., Cho, S.H., Lee, J.D., & Kim, H.S. (2023) Itch and janus kinase inhibitors. Acta Derm. Venereol., 103, adv00869.
8) A study to evaluate the efficacy and safety of INCB054707 in participants with prurigo nodularis. https://www.incyteclinicaltrials.com/study/?id=INCB%2054707-206.
9) Murrell, D.F., Joly, P., Werth, V.P., Ujiie, H., Worm, M., Mangold, A.R., Avetisova, E., Maloney, J., Laws, E., Mortensen, E., et al. (2024) Study design of a phase 2/3 randomized controlled trial of dupilumab in adults with bullous pemphigoid: LIBERTY-BP ADEPT. Adv. Ther., 41, 2991–3002.
10) Huang, D., Zhang, Y., Kong, L., Lu, J., & Shi, Y. (2023) Janus kinase inhibitors in autoimmune bullous diseases. Front. Immunol., 14, 1220887.
11) Zuberbier, T., Ensina, L.F., Giménez-Arnau, A., Grattan, C., Kocatürk, E., Kulthanan, K., Kolkhir, P., & Maurer, M. (2024) Chronic urticaria: Unmet needs, emerging drugs, and new perspectives on personalised treatment. Lancet, 404, 393–404.
12) Tominaga, M. & Takamori, K. (2022) Peripheral itch sensitization in atopic dermatitis. Allergol. Int., 71, 265–277.
著者紹介Author Profile
 本田 哲也(ほんだ てつや)
本田 哲也(ほんだ てつや)浜松医科大学皮膚科学講座教授.博士(医学).
略歴2000年京都大学医学部卒業.京都大学医学部皮膚科学講座助教,米国国立衛生研究所等を経て20年より現職.
研究テーマ炎症性皮膚疾患の病態解明,痒み,皮膚バリア.実臨床での疑問の解明・実臨床への応用につながる成果を目指しています.
ウェブサイトhttps://hama-med-derma.jp/