そもそも痒みとは生体防御反応の一つとして考えられており,特に外部寄生虫に対する機械的排除機構として脊椎動物に広く備わっている獲得能力と解釈されている.特に,造血幹細胞に由来するマスト細胞は,真皮と皮下組織に多く分布するが出生前より分化を完了している1).自然界では出生直後より外部寄生虫の侵襲にさらされるが,その際に放出されるヒスタミンなどの起炎性ケミカルメディエーターは痒みを誘導する.この排除機構は自然免疫だけでなく獲得免疫としても機能するが,好塩基球もこれに類するエフェクター細胞である2, 3).マダニが吸血時にヒスタミン分解酵素を吸血部位に放出し,ヒスタミンを不活性化することから,宿主–寄生体関係を論ずるとき,大変興味深いものがある.通常,痒みを認知し掻破を誘導するのだが,掻破によって寄生体を排除したあとには,その役割を収束させる.しかしながら,アトピー性皮膚炎などのように本来の役割とは異なる痒みの発現機構や病態収束機構についてはいまだ不明な点も多く,原因の完全究明には至っていない.
日本アレルギー学会・日本皮膚科学会によるガイドラインによれば,アトピー性皮膚炎は,以下のように定義されている.「増悪と軽快を繰り返す掻痒のある湿疹を主病変とする疾患であり,患者の多くはアトピー素因を持つ.」アトピー素因とは,アトピー性皮膚炎,気管支喘息,アレルギー性鼻炎・結膜炎のいずれか,あるいは複数の既往歴や家族歴を有し,IgE抗体を産生しやすい体質であるとされている.つまり,アトピー性皮膚炎はその原因および素因が明確に定義されているわけではなく,あくまでも症候群なのである.疾患モデル動物を開発・作製するにあたり,基本となるのは原因遺伝子あるいは分子が明確となっていることである.たとえば,マスト細胞の機能を解明するにあたり,マスト細胞欠損マウスを作製するとき,その分化機構が明らかになっていれば,現在の遺伝子操作技術をもってすれば,比較的容易に作製が可能である.上述したとおり,アトピー性皮膚炎は多岐にわたる外因性および内因性要因が複雑に絡み合って発症すると考えられ,このことがその病態解明をいっそう困難にさせているのである.しかし,今日では,研究者のたゆまぬ努力によって,患者の病態とその特性が明らかにされようとしている.その基礎的成果をもとに,いくつかの特異的症状を実験動物で再現させることに成功し,最近ではその結果が分子標的治療薬として結実しつつある.
他方,痒みの程度は掻破行動(回数と持続時間)を定量化することで評価が可能である.マウスの場合,過去において掻破行動の測定は目視によることがほとんどであった.しかし,マウスの掻破行動は30フレーム/秒を超える速度で発現することから,目視による判断ではたとえ通常のビデオ動画を再生しても,画像は不鮮明となり正確な行動を確認できない.とはいえ高速度カメラ画像を利用した場合,そのカウントには長時間を要し,実験者の負担は莫大なものとなる.要するに,掻破行動の定量化には,正確な基準で短時間に再現できる測定技術のブレークスルーが必須であった.本稿では,アトピー性皮膚炎の疾患モデル動物および掻破行動定量化システムの開発の流れを概説したい.
1)自然発症モデル
数種の実験動物がアトピー性皮膚炎モデルとして報告されているが,その病態と原因については患者とのシンテニー解析(遺伝子の配列類似性から相同遺伝子を推測する手法)が十分に行われているわけではない.その結果,アトピー性皮膚炎様症状との理解の上にたった表現型の詳細な解析の重要性は高まっている.したがって本稿では,現時点において多角的に解析のなされた信頼性のある代表的なモデル動物について紹介する.
a.NC/Tndマウス
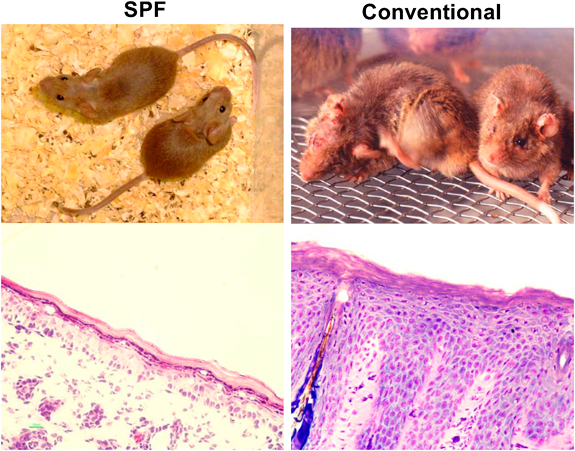
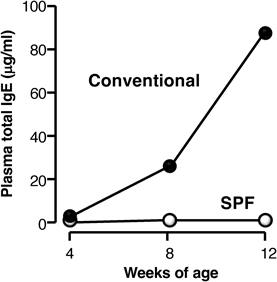
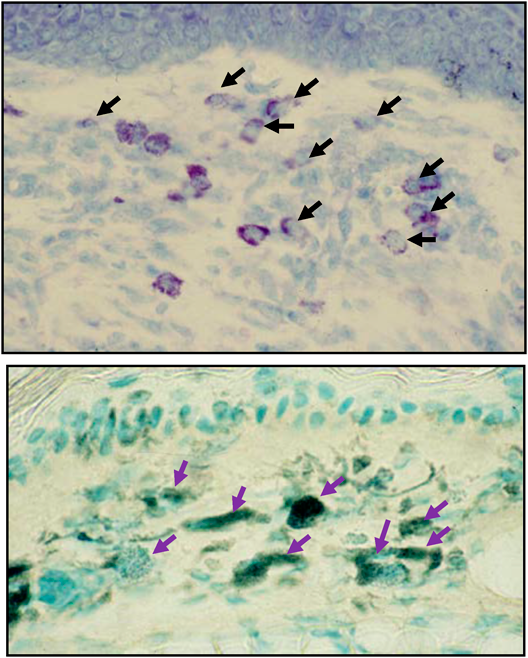
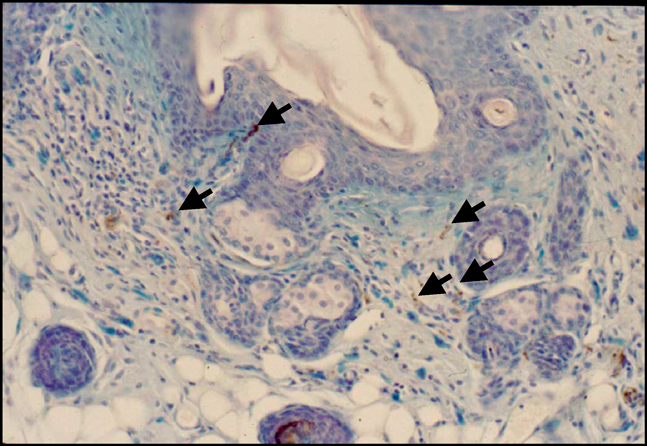
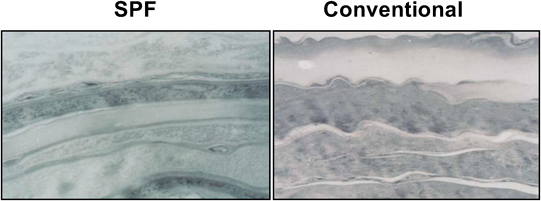
我々の研究室にてNC/Ngaマウスより樹立された近交系マウスである.NC/Ngaマウスは古くからわが国で飼育されていた愛玩用のハツカネズミに由来する.ニシキネズミと呼ばれ,その頭文字からN,そして毛色のシナモンからCとして,名古屋大学の近藤らの研究グループによって命名樹立されたマウスである.このマウスが皮膚病変を発症することは当初より気づいていたが,いつくかのサブラインは発症しない事実から,長い間皮膚病発症については不明のままであった.我々は,皮膚病の発症個体を選別し,100世代以上継代することによって,環境依存性のNC/Tndマウスを樹立した.NC/Tndマウスは,SPF環境(空気清浄環境)下においては自然発症しないが,conventional環境(空気清浄を行っていない通常環境)下においては,7~8週齢になると掻破行動を伴う肉眼でも認知可能な皮膚炎を自然発症する(図1).掻破行動と皮膚炎は加齢とともに増悪化するが,同時に血中総IgE濃度も上昇する(図2).この現象に雌雄差はない4).皮膚炎の病態は図1で示したように,形態学的には,過角化を伴う表皮肥厚,乳頭間隆起,真皮および皮下組織内におけるマスト細胞増加やTh2細胞の浸潤など,アトピー性皮膚炎患者と比較した場合,ほぼ一致している.マスト細胞にはIgEが結合していることから(図3),アレルゲンの侵入によって,速やかに活性化・脱顆粒し,さまざまなケミカルメディエーターを放出し,掻破行動や皮膚病を惹起させる.事実,マスト細胞に知覚神経が接触していることは,痒み発現の形態学的な証拠を提示している(図4).また,皮膚バリア機能恒常性および保水性についての解析でも,水分蒸発量増加および水分含量減少が確認され,これを裏づけるように角層におけるセラミド減少5)や表皮のタイトジャンクション分子の発現低下6)を確認している.これらは患者で報告されている現象と一致している.我々はさらに,皮膚病変について,透過型電子顕微鏡観察(図5)および抗IV型コラーゲン抗体による免疫染色を実施した.その結果,病変部の基底膜が一部断裂しており,その部位においてIV型コラーゲンの消失が確認された.この現象は肉眼所見では認められない生後4週齢ですでに発現していたことから,基底膜の構造の不安定性が皮膚バリア機能の低下を招く一要因となっている可能性がある.他方,面白いことに近年アトピー性皮膚炎と皮膚バリアの関連で話題となったfilaggrin分子およびその分解産物はむしろ増加している7).これは,NC/Tndマウスはfilaggrin産生には異常がないことを示すだけでなく,低下した皮膚バリア機能を補う代償的な反応であろうと推測される.
さて,発表の場で必ずといってよいほど受ける質問が,通常環境下で皮膚炎発症したマウスをSPFと同様の環境下に飼育環境を変えた場合,皮膚炎はどうなるのかということである.答えは,皮膚病変は「減弱はするものの自然治癒はしない」である.つまり,一度引き金が引かれると,完治することがなかったのである.その後,免疫学的解析により,B細胞のIL-4高感受性が高IgE血症の原因の一つであること8),またかつてアトピー性皮膚炎の治療応用として検討されたIFN-γやIL-12などは,in vitroおよびin vivoの解析によっておおむね無効であったことが明らかとなり9),抑制応答とその能力が十分でないことが推測されている.
我々研究グループは,皮膚炎発症および高IgE血症の遺伝解析を目的に,BALB/cマウスとの交配,F1交配,および戻し交配を行った10).その結果,これらの現象は常染色体上に位置する劣性(潜性)遺伝子によって惹起され,皮膚炎の原因遺伝子は一つ,高IgE血症は二つの異なる遺伝子が関与しているものと推察された.また,興味深いことに,高IgE血症が認められる個体が必ずしも皮膚炎を発症しないことから,皮膚炎および高IgE血症の原因遺伝子は異なることが考えられ,事実IgE欠損NC/Tndマウスにおいても皮膚炎は発症する.ただし,発症時期が遅れることから,IgEは皮膚炎の増悪化因子であろう.
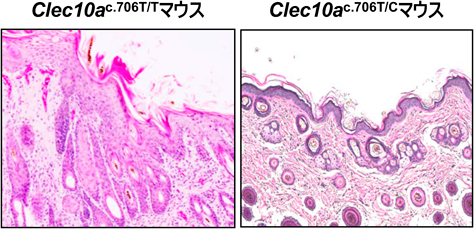
前述したNC/Tndマウスの免疫学的高感受性について,その原因となる特性の一部を筑波大学との共同研究で最近発見報告したので紹介したい11).ダニ抗原は強力なアレルゲン性を有することが知られているが,これをNC/Tndマウスの皮膚に繰り返し塗布することによって,アトピー性皮膚炎様症状を惹起できる.ダニは抗原性と非抗原性分子によって構成されるが,免疫応答における後者の関与については不明であった.C型レクチン受容体であるClec10aに着目し遺伝子解析を行った.この分子は,ムチン様分子の受容体であり,活性化によって抑制性ITAM(immunoreceptor tyrosine-based activation motif)として機能することがわかっている.野生型のNC/Tndマウスは,c.706部位にstop-gain変異が存在し,細胞外のC型レクチン様ドメインを欠損している(Clec10ac.706T/T).したがって,NC/TndマウスのClec10aはそのリガンドと結合できず,抑制シグナルが欠如しているのである.つまり,Toll-like受容体を介した刺激誘導性シグナルが一度活性化すると,炎症性サイトカインなどの産生を抑制することができなくなるのである.実際に,CRISPR-Cas9システムによって正常化させたC57BL/6と同じNC/Tnd-Clec10ac.706T/Cマウスでは,炎症性サイトカイン産生は低下し,ダニ抗原誘導性の皮膚炎もかなり抑えられた(図6).シンテニー解析で,ヒトではClec10aはasialoglycoprotein receptor 1(Asgr1)であることが判明していることから,今後アトピー性皮膚炎患者におけるこの分子の解析が必要である.
b.Flaky tailマウス
このマウスは英国のSearleらによって樹立されたmatted(ma)マウスを起源としたマウスで,角層に存在する天然保湿因子であるfilaggrinの機能喪失変異を有することから,皮膚バリアの機能障害が発現すると考えられていた.また,2006年にアトピー性皮膚炎患者の一部にfilaggrinの遺伝子変異があることが報告されたことも相まって12),アトピー性皮膚炎類似皮膚炎症状と総IgE濃度の上昇を呈するFlaky tailマウスに研究者の注目が集まった.その後の詳細な解析によって,Flaky tailマウスの特異症状は,filaggrin遺伝子を欠損しても発現しなかったこと,そして皮膚炎を誘導する原因がma変異であることが明らかとなっている13).この変異は新規皮膚バリア遺伝子(Tmem79)に生じたもので,角層成熟タンパク質の分泌と角質形成異常を惹起する.アトピー性皮膚炎患者における今後の解析が待たれる.
2)遺伝子操作マウス
a.Th2サイトカイントランスジェニックマウス
MosmannとCoffmanによって提唱されたTh1/Th2サイトカインバランス仮説は免疫・炎症性疾患の病態発現機構の説明によく引用されるが,アトピー性皮膚炎もまた例外ではなく,Th2サイトカインの代表格であるIL-4への着目は必然であった.1990年,IL-4トランスジェニックマウス作出の試みがなされ,IgEの高産生とアレルギー性眼瞼炎を報告している14).この時点で,現在アトピー性皮膚炎治療薬として最も有効とされるdupilumab(抗IL-4/IL-13受容体モノクローナル抗体)15, 16)の有効性を想像した研究者はどれほどいただろうか? アトピー性皮膚炎のように原因および要因が多岐にわたる場合,サイトカインネットワークの観点から1種のサイトカインでコントロールできるとは考えがたい.したがって,この治療薬の開発の成功は,驚くべきかつ画期的なことである.IL-4受容体は1型と2型が存在し,IL-13は2型受容体に結合することから,受容体の活性化を推測し,IL-13トランスジェニックマウスが作出されている17).また,内因性起痒物質に関する研究成果に基づき,IL-3118)やケラチノサイト由来thymic stromal lymphopoietic(TSLP)のトランスジェニックマウスが作出され19),前者では全身の掻痒症,脱毛,皮膚炎が,後者では皮膚炎と高IgE血症が観察されている.なお,両者とも皮膚炎はアトピー性皮膚炎に類似している.その他にもいくつかのサイトカインやシグナル分子を過剰発現するマウスが報告されている20, 21).
b.遺伝子欠損マウス
FADSマウスは富山大学と佐賀大学で共同開発されたマウスで,転写因子であるNF-κBの活性化プロセスに関与する重要なシグナル分子IKK2を標的にしている22).頭部の皮膚線維芽細胞特異的にこの分子を欠失させた結果,顔面のみに強い掻痒を伴う皮膚炎を自然発症する.このことがFacial Atopic Dermatitis with Scratching(FADS)の由来となっている.Th2サイトカイン高産生,高IgE血症など,その表現型はアトピー性皮膚炎に類似している.本特集ではこのマウスを利用した研究紹介があるので,詳細は出原らの稿を参照していただきたい.
Adam17fl/fl Sox9-Creマウスは,ケラチノサイトにおけるdisintegrinとmetalloproteinase 17(ADAM17)を欠損させたもので,皮膚の乾燥から始まり,湿疹へと病態が進行する23).アトピー性皮膚炎の皮膚病変からは,皮膚の常在細菌叢が変化し高率に黄色ブドウ球菌が分離される.このマウスは,黄色ブドウ球菌が病態発現に強く関与することが報告されている.
3)皮膚炎誘導モデル
ハプテン(ピクリルクロライド,TNCBなど)やダニ抗原を一定の間隔で皮膚に塗布することによって発症させるモデルである.後者の場合は前処置として皮膚バリアを破壊しておく必要がある.この手法は,Th1型の接触性皮膚過敏症のモデルとして確立されていたが,繰り返しの感作によって,高IgE血症を伴うアトピー性皮膚炎類似の病態が発現するようになる.これは,Th1とTh2の混在した異常免疫状態を示している.最近では,この手法をNCマウスやFlaky tailマウスに応用し,よりアトピー性皮膚炎に酷似した病態を惹起させ,解析が行われている.特に,ヒトの住環境に存在し,強いアレルゲン性を有するダニ抗原の利用は有効な手段と考えられる.
痒みの評価は,掻破行動の回数と持続時間を測定することで可能となる.以下に手法の特性を述べる.
1)ビデオ画像目視測定法
これは,一般のビデオカメラで撮影した画像を研究者が目視でカウントする古典的な手法である.この手法の利点は,なんといってもビデオカメラだけ用意すればよいことである.また,再現が可能である.他方,欠点は,通常のビデオカメラでは,マウスの掻破行動が30フレーム/秒よりも速いことから画像が不鮮明となり,得られるデータが測定者によって異なること,また再現性に乏しいということにある.ゆえに,複数の測定者が実施する必要があり,その費用対効果は低い.精度を高めるためには高速度カメラの利用が考えられるが,再現には長時間を要することになり,現実的ではない.さらに,撮影にはある程度の照明強度が必要で,サーカディアンリズムを考慮した場合,長時間の撮影には不向きである.
2)磁場変化を利用した測定法
目視による画像解析の欠点を補うため,まったく異なるコンセプトで開発された手法で,マウスの後肢にマグネットを装着させ,磁場の変化から掻破行動を抽出して定量化する24).この手法はビデオ画像目視測定法に比べ,優位性を有するが,以下の欠点を有する.すなわち,波形データからの解析であるがゆえに,実際の掻破行動を抽出したかどうかをチェックできないこと,マグネットの装着が侵襲的であり,装着に時間を要することなどがあげられる.
3)自動高速度ビジョン解析評価法
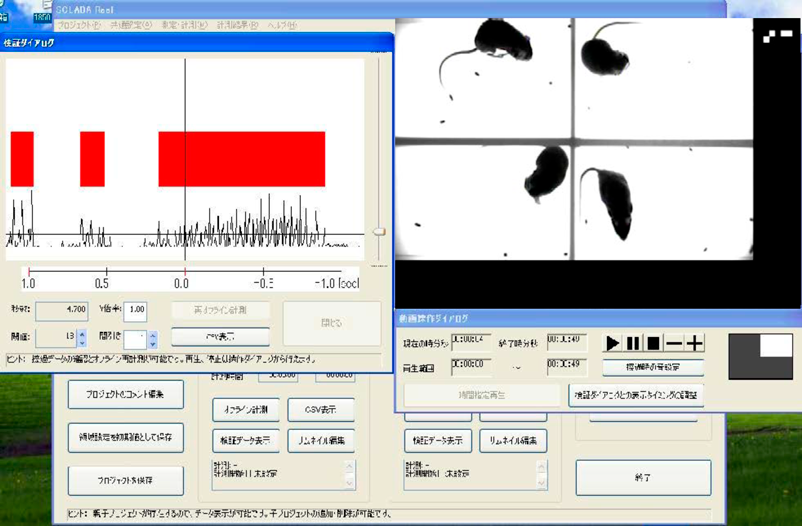
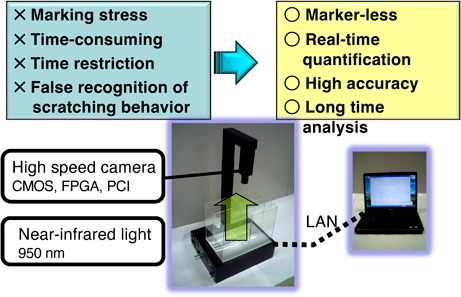
我々は,画像処理組込み型高速度ビジョンカメラを利用し,マウスの掻破行動の完全抽出に成功した25).240フレーム/秒の画像は,二値化,フレーム間の面積差分をカメラ内で算出して,コンピュータに高速にデータを送り,掻破回数と掻破時間をほぼリアルタイムに計算させることができる(図7).ソフトウェアによって抽出画像のサムネールをすべてチェックでき,精度はきわめて高い.さらに4匹同時に撮影でき,また照明は動物の目には見えない近赤外線ライトを利用しているため,サーカディアンリズムに影響を与えることなく測定ができる.また,マウスに直接デバイスを装着する必要がないため,ストレスフリーで長時間解析が可能となる(図8).
さまざまなアトピー性皮膚炎モデル動物が開発されているが,研究者の解析目標から適切なモデル動物を選択し,有効な測定法を実施することが肝要である.重要なのは,それを利用した病態解析と患者におけるシンテニー解析が交互に実施され,より本質に近づけることであり,これを元に新たな予防薬や治療薬の開発が成功することを期待したい.
最後に,我々の直近の研究成果の概略を紹介し,本稿を閉じたい.慢性難治性疾患にはうつ病などの精神神経疾患を併発することが知られている.特にアトピー性皮膚炎患者では10%を超える頻度でうつ病が続発することが報告されている26).したがって,皮膚炎の治療に加えてうつ病への対処も重要である.そこで,我々はNC/Tndマウスにうつ様症状が発症するかどうかを検証した.活動性・不安様行動評価,嗜好性評価,さらに学習性絶望評価を,それぞれ,オープンフィールド試験,ショ糖嗜好性試験,尾懸垂試験で行った結果,皮膚炎の発症が確認された直後,9週齢において,うつ様状態にあることが判明した.さらに,その早期誘導因子も解明できたことから,今後新たな治療戦略を提示できるであろう.
引用文献References
1) Kitamura, Y., Kasugai, T.M., Nomura, S., & Matsuda, H. (1993) Development of mast cells and basophils. In Immunopharmacology of Mast cells and Basophils (Foreman, J.C. ed.), pp. 5–27, Academic Press, London.
2) Matsuda, H., Fukui, K., Kiso, Y., & Kitamura, Y. (1985) Inability of genetically mast cell-deficient W/Wv mice to acquire resistance against larval Haemaphysalis longicornis ticks. J. Parasitol., 71, 443–448.
3) Matsuda, H., Watanabe, N., Kiso, Y., Hirota, S., Ushio, H., Kannan, Y., Azuma, M., Koyama, H., & Kitamura, Y. (1990) Necessity of IgE antibodies and mast cells for manifestation of resistance against larval Haemaphysalis longicornis ticks in mice. J. Immunol., 144, 259–262.
4) Matsuda, H., Watanabe, N., Geba, G.P., Sperl, J., Tsudzuki, M., Hiroi, J., Matsumoto, M., Ushio, H., Saito, S., Askenase, P.W., et al. (1997) Development of atopic dermatitis-like skin lesion with IgE hyperproduction in NC/Nga mice. Int. Immunol., 8, 461–466.
5) Aioi, A., Tonogaito, H., Suto, H., Hamada, K., Ra, C., Ogawa, H., Maiback, H., & Matsuda, H. (2001) Impairment of skin barrier function in NC/Nga Tnd mice as a possible model for atopic dermatitis. Br. J. Dermatol., 144, 12–18.
6) AI Kindi, A., Williams, H., Matsuda, K., Alkahtani, A.M., Saville, C.S., Bennett, H., Alshammari, Y., Tan, S.Y., O’Neill, C., Tanaka, A., et al. (2021) Staphylococcus aureus second immunoglobulin-binding protein drives atopic dermatitis via IL-33. J. Allergy Clin. Immunol., 147, 1354–1368.
7) Jang, H., Matsuda, A., Jung, K., Karasawa, K., Matsuda, K., Oida, K., Ishizaka, S., Ahn, G., Amagai, Y., Moon, C., et al. (2016) Skin pH is the master switch of Kallikrein 5-Mediated skin barrier destruction in a murine atopic dermatitis model. J. Invest. Dermatol., 136, 127–135.
8) Matsumoto, M., Ra, C., Kawamoto, K., Sato, H., Itakura, A., Sawada, J., Ushio, H., Suto, H., Mitsuishi, K., Hikasa, Y., et al. (1999) IgE hyperproduction through enhanced tyrosine phosphorylation of Janus kinase 3 in NC/Nga mice, a model for human atopic dermatitis. J. Immunol., 162, 1056–1063.
9) Matsumoto, M., Itakura, A., Tanaka, A., Fujisawa, C., & Matsuda, H. (2001) Inability of IL-12 to down-regulate IgE synthesis due to defective production of IFN-gamma in atopic NC/Nga mice. J. Immunol., 167, 5955–5962.
10) Kohara, Y., Tanabe, K., Matsuoka, K., Kanda, N., Matsuda, H., Karasuyama, H., & Yonekawa, H. (2001) A major determinant quantitative-trait locus responsible for atopic dermatitis-like skin lesions in NC/Nga mice is located on Chromosome 9. Immunogenetics, 53, 15–21.
11) Kanemaru, K., Noguchi, E., Tahara-Hanaoka, S., Mizuno, S., Tateno, H., Denda-Nagai, K., Irimura, T., Matsuda, H., Sugiyama, F., Takahashi, S., et al. (2019) Clec10a regulates mite-induced dermatitis. Sci. Immunol., 4, eaax6908.
12) Palmer, C.N., Irvine, A.D., Terron-Kwiatkowski, A., Zhao, Y., Liao, H., Lee, S.P., Goudie, D.R., Sandilands, A., Campbell, L.E., Smith, F.J., et al. (2006) Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis. Nat. Genet., 38, 441–446.
13) Sasaki, T., Shiohama, A., Kubo, A., Kawasaki, H., Ishida-Yamamoto, A., Yamada, T., Hachiya, T., Shimizu, A., Okano, H., Kudoh, J., et al. (2013) A homozygous nonsense mutation in the gene for Tmem79, a component for the lamellar granule secretory system, produces spontaneous eczema in an experimental model of atopic dermatitis. J. Allergy Clin. Immunol., 132, 1111–1120.e4.
14) Tepper, R.I., Levinson, D.A., Stanger, B.Z., Campos-Torres, J., Abbas, A.K., & Leder, P. (1990) IL-4 induces allergic-like inflammatory disease and alters T cell development in transgenic mice. Cell, 62, 457–467.
15) Guttman-Yassky, E., Bissonnette, R., Ungar, B., Suárez-Fariñas, M., Ardeleanu, M., Esaki, H., Suprun, M., Estrada, Y., Xu, H., Peng, X., et al. (2019) Dupilumab progressively improves systemic and cutaneous abnormalities in patients with atopic dermatitis. J. Allergy Clin. Immunol., 143, 155–172.
16) Simpson, E.L., Bieber, T., Guttman-Yassky, E., Beck, L.A., Blauvelt, A., Cork, M.J., Silverberg, J.I., Deleuran, M., Kataoka, Y., Lacour, J.P., et al.; SOLO 1 and SOLO 2 Investigators. (2016) Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N. Engl. J. Med., 375, 2335–2348.
17) Zheng, T., Oh, M.H., Oh, S.Y., Schroeder, J.T., Glick, A.B., & Zhu, Z. (2009) Transgenic expression of interleukin-13 in the skin induces a pruritic dermatitis and skin remodeling. J. Invest. Dermatol., 129, 742–751.
18) Dillon, S.R., Sprecher, C., Hammond, A., Bilsborough, J., Rosenfeld-Franklin, M., Presnell, S.R., Haugen, H.S., Maurer, M., Harder, B., Johnston, J., et al. (2004) Interleukin 31, a cytokine produced by activated T cells, induces dermatitis in mice. Nat. Immunol., 5, 752–760.
19) Yoo, J., Omori, M., Gyarmati, D., Zhou, B., Aye, T., Brewer, A., Comeau, M.R., Campbell, D.J., & Ziegler, S.F. (2005) Spontaneous atopic dermatitis in mice expressing an inducible thymic stromal lymphopoietin transgene specifically in the skin. J. Exp. Med., 202, 541–549.
20) Konishi, H., Tsutsui, H., Murakami, T., Yumikura-Futatsugi, S., Yamanaka, K., Tanaka, M., Iwakura, Y., Suzuki, N., Takeda, K., Akira, S., et al. (2002) IL-18 contributes to the spontaneous development of atopic dermatitis-like inflammatory skin lesion independently of IgE/stat6 under specific pathogen-free conditions. Proc. Natl. Acad. Sci. USA, 99, 11340–11345.
21) Imai, Y., Yasuda, K., Sakaguchi, Y., Haneda, T., Mizutani, H., Yoshimoto, T., Nakanishi, K., & Yamanishi, K. (2013) Skin-specific expression of IL-33 activates group 2 innate lymphoid cells and elicits atopic dermatitis-like inflammation in mice. Proc. Natl. Acad. Sci. USA, 110, 13921–13926.
22) Nunomura, S., Ejiri, N., Kitajima, M., Nanri, Y., Arima, K., Mitamura, Y., Yoshihara, T., Fujii, K., Takao, K., Imura, J., et al. (2019) Establishment of a mouse model of atopic dermatitis by deleting Ikk2 in dermal fibroblasts. J. Invest. Dermatol., 139, 1274–1283.
23) Kobayashi, T., Glatz, M., Horiuchi, K., Kawasaki, H., Akiyama, H., Kaplan, D.H., Kong, H.H., Amagai, M., & Nagao, K. (2015) Dysbiosis and staphylococcus aureus colonization drives inflammation in atopic dermatitis. Immunity, 42, 756–766.
24) Kim, J., Igeta, K., Nagao, M., Inagaki, N., & Nagai, H. (2001) Evaluation of mouse scratching behavior using a new apparatus, MicroAct. Jpn. J. Pharmacol., 85(Suppl.), 119.
25) Nie, Y., Takaki, T., Ishii, I., & Matsuda, H.(2011) IEEE International Conference on Robotics and Automation, DOI: 10.1109/ICRA.2011.5979791
26) Dalgard, F.J., Gieler, U., Tomas-Aragones, L., Lien, L., Poot, F., Jemec, G.B.E., Misery, L., Szabo, C., Linder, D., Sampogna, F., et al. (2015) The psychological burden of skin diseases: A cross-sectional multicenter study among dermatological out-patients in 13 European countries. J. Invest. Dermatol., 135, 984–991.