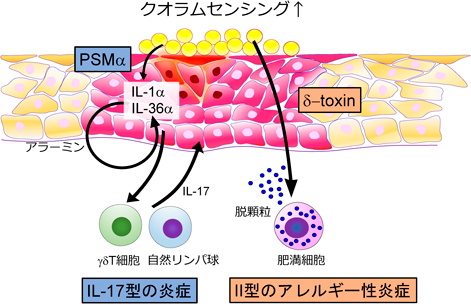
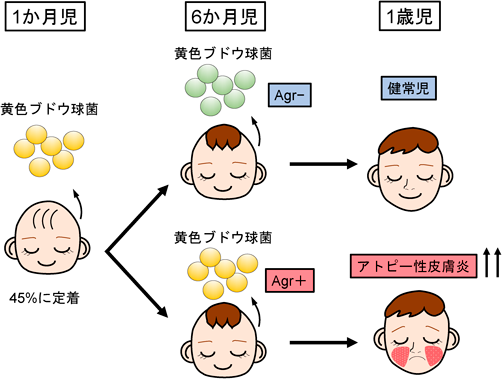
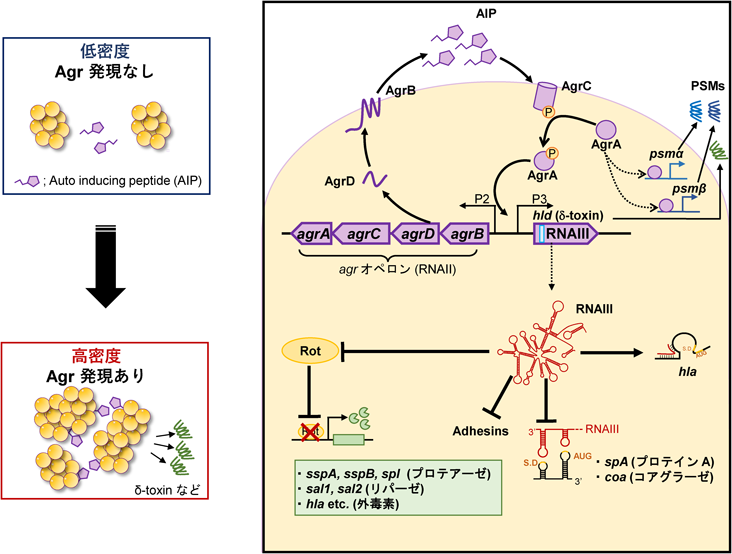
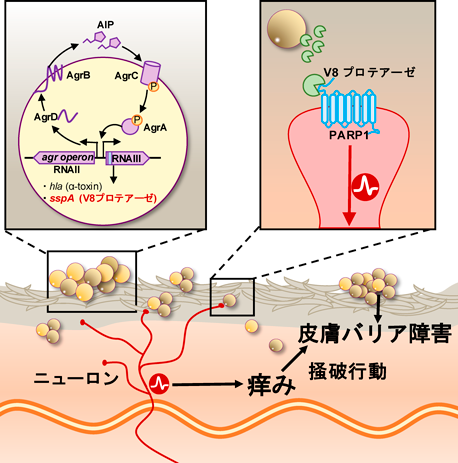
皮膚微生物叢,黄色ブドウ球菌とアトピー性皮膚炎の痒みSkin microbiome and itch of atopic dermatitis
1 大阪大学大学院医学系研究科皮膚免疫微生物学共同研究講座Cutaneous Immunology and Microbiology, Graduate School of Medicine, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘2–2 ◇ 2–2 Yamadaoka, Suita, Osaka 565–0871, Japan
2 大阪大学免疫学フロンティア研究センター皮膚アレルギー・生体防御Cutaneous Allergy and Host Defense, Immunology Frontier Research Center, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘2–2 ◇ 2–2 Yamadaoka, Suita, Osaka 565–0871, Japan