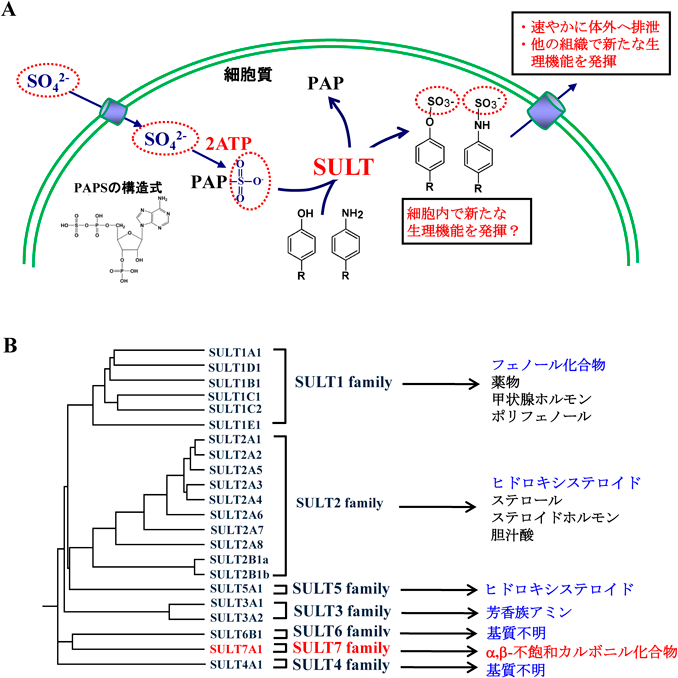
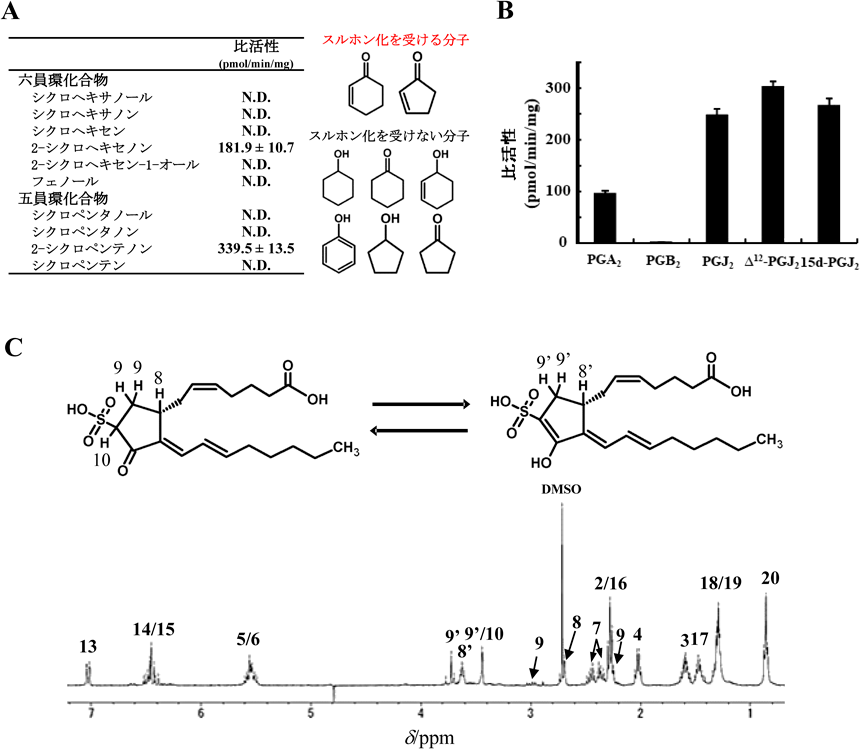
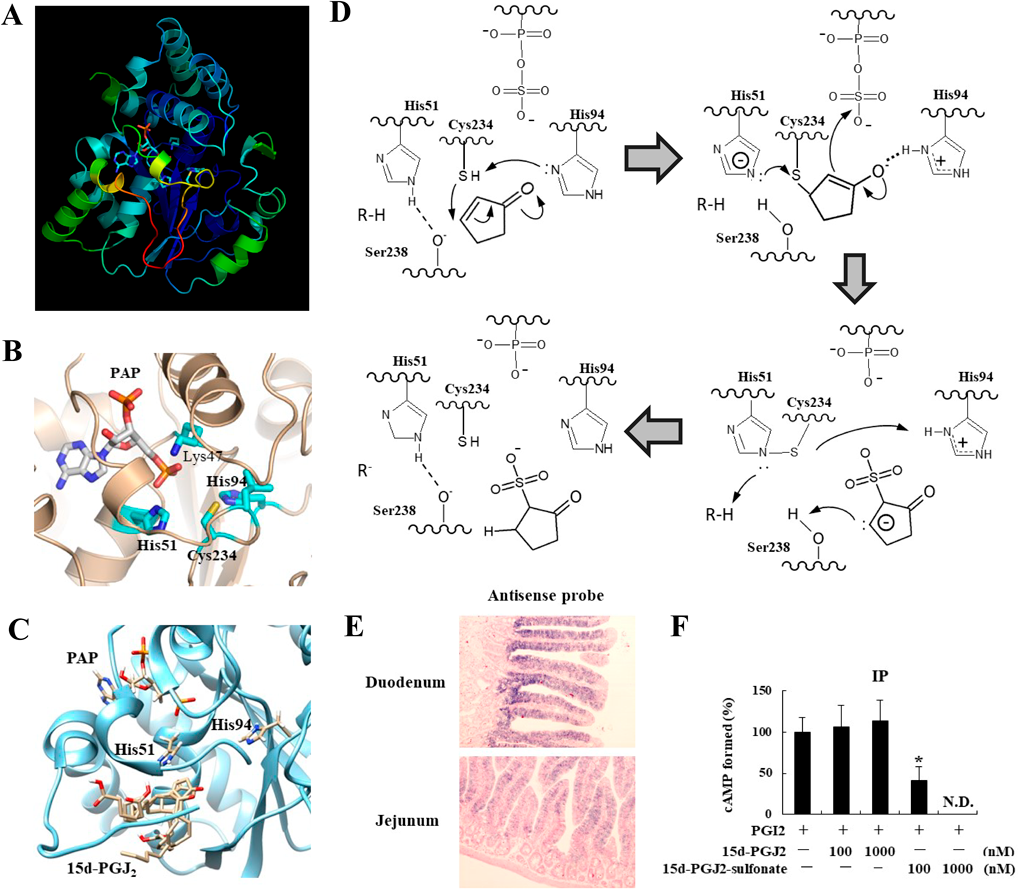
細胞質硫酸転移酵素の新たな生理機能: α,β-不飽和カルボニルスルホン化反応の発見とその生理機能New physiological functions of cytosolic sulfotransferases: Discovery of sulfonation of α,β-unsaturated carbonyl groups and its physiological functions
宮崎大学農学部応用生物科学科Department of Biosciences and Applied Biochemistry, Faculty of Agriculture, University of Miyazaki ◇ 〒889–2192 宮崎県宮崎市学園木花台西1–1 農学部南棟S707 ◇ S707 Agriculture Build., Gakuenkibanadai-nishi 1–1, Miyazaki, Miyazaki 889–2192, Japan