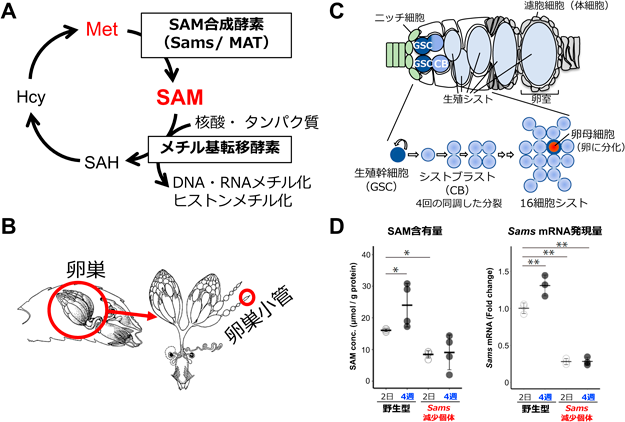
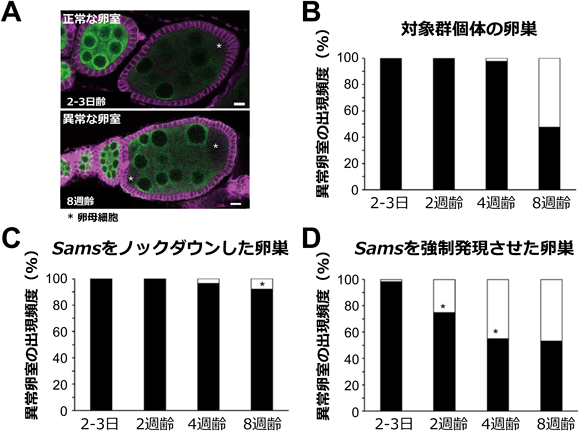
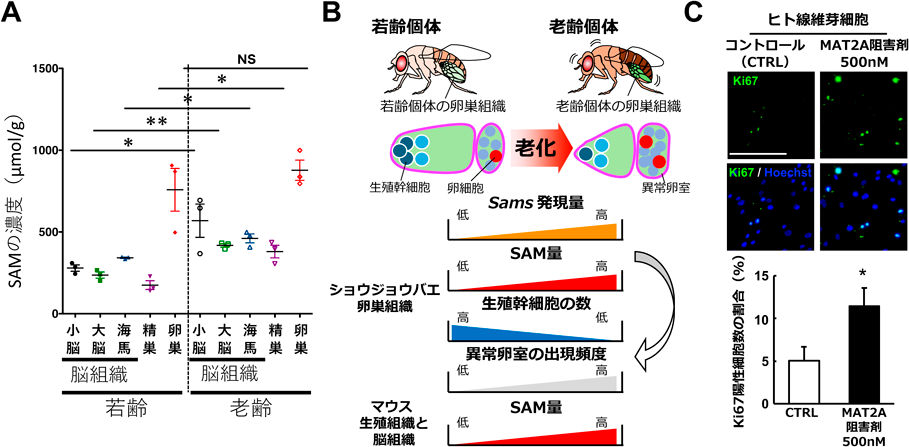
メチオニン代謝による組織老化制御Regulation of tissue ageing by methionine metabolism conserved among animal species
1 国立研究開発法人産業技術総合研究所モレキュラーバイオシステム研究部門 バイオシステム応用研究グループMolecular Neurophysiology Research Group, Biomedical Research Institute, National Institute of Advanced Industrial Science and Technology (AIST) ◇ 〒305–8566 茨城県つくば市東1–1–1 産総研つくば中央第6(6–10) ◇ 1–1–1 Higashi, Tsukuba, Ibaraki 305–8566, Japan
2 九州大学理学研究院生物科学部門Department of Biology, Faculty of Science, Kyushu University ◇ 〒819–0395 福岡県福岡市西区元岡744 ◇ 744 Moto-oka, Nishi-ku, Fukuoka, Fukuoka 819–0395, Japan