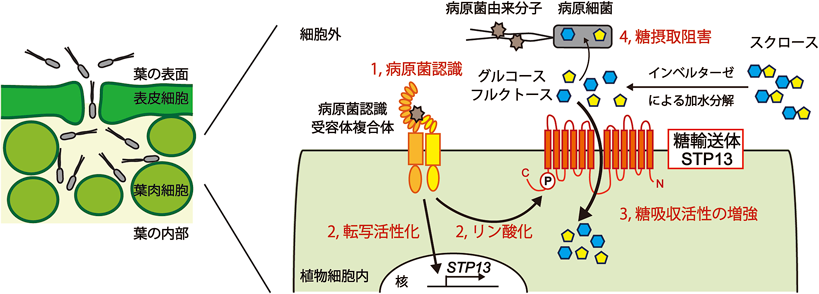
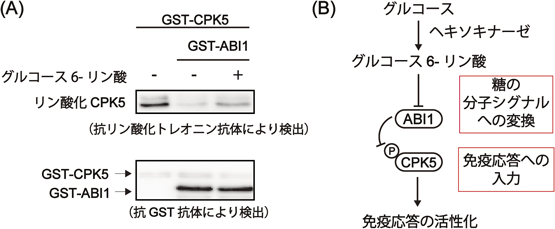
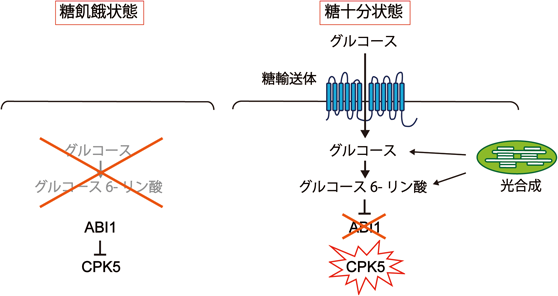
糖を巡る植物–病原菌間相互作用How does sugar affect plant-pathogen interactions?
徳島大学大学院社会産業理工学研究部生物資源産業学域Graduate School of Technology, Industrial and Social Sciences, Tokushima University ◇ 〒770–8506 徳島県徳島市南常三島町2–1 ◇ 2–1 Minami-josanjima-cho, Tokushima, Tokushima 770–8506, Japan