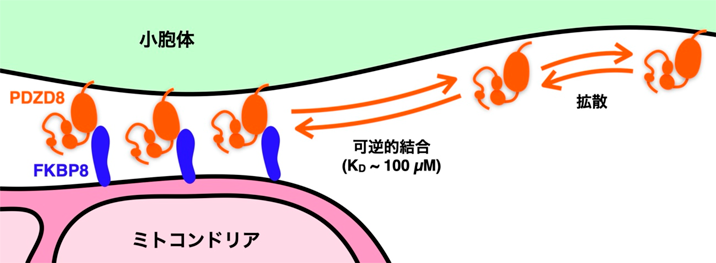
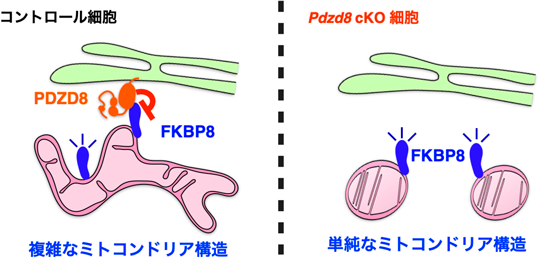
PDZD8–FKBP8複合体による哺乳類細胞のミトコンドリア–小胞体接触場形成とその意義Mechanism and function of mitochondria–endoplasmic reticulum contact site formation by the PDZD8–FKBP8 complex in mammalian cells
東京大学大学院工学系研究科化学生命工学専攻Department of Chemistry and Biotechnology, School of Engineering, The University of Tokyo ◇ 〒113–8656 東京都文京区本郷7–3–1 ◇ 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–8656, Japan