我々の脳機能を支える神経回路は多数の神経細胞の間の精密なシナプス結合によって成り立っている.したがって,精密なシナプス結合がどのように作られるのかを理解することは,我々の脳機能や精神の源を理解することにほかならない.一般的に,神経回路形成は,二つの異なる段階を経て完成すると考えられている1).はじめに,遺伝的なプログラムや,それによって規定される分子的な神経突起誘導因子によって大まかな回路が形作られる.次いで,神経活動依存的な神経回路の再編成が生じ,より精緻な神経接続が完成する.特に,後者は,胎生後期から生後初期に生じることが知られている.
神経突起誘導因子については,すでに誘因性,反発性を含む多くの分子が同定されており,その基本的なロジックはほとんど明らかにされているといってよい2).また,シナプス形成についても,シナプス形成を誘導するシナプスオーガナイザーが多く同定されている3).しかしながら,遺伝子によってコードされた分子は種類に限りがあり,それらだけで膨大な神経細胞から構成される哺乳類の精緻な神経回路を作り上げることは困難である.
最初の段階で大まかな接続を作り上げた神経回路は,その後の神経活動依存的な再編成の過程で精緻化される.哺乳類の神経回路が発達期の神経活動によって再編成されることは,60年前にHubelとWieselによって明らかにされた.たとえば,発達期に片眼遮蔽を行うと,第一次視覚野において,閉じていた眼からの入力が減少し,開いていた眼からの入力が増える4).これは眼優位性可塑性として知られている.一方,両眼遮蔽では左右の入力は保たれる5).したがって,シナプス刈り込みは,単にシナプス入力が少ないと起こるというわけではなく,左右の入力の相対的な強度によって決まる.一方,視覚経路の中継地点である外側膝状体にある個々の神経細胞は,はじめは左右両方の眼からの入力を受け入れているが,生後の神経活動依存的な再編成によって,最終的に左右どちらかの入力のみを受け入れるようになる6).
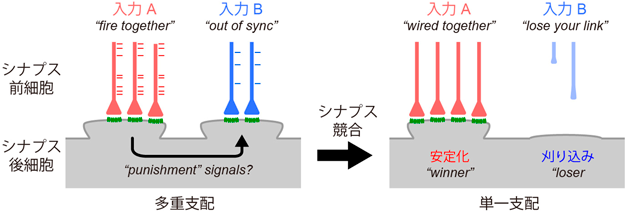
こうした神経回路の再編成には,神経活動のタイミングも重要であると考えられている.Hebbは,シナプス前細胞と後細胞が同じタイミングで活動すると,そのシナプスが強化されるという,いわゆるHebb則を提案した7).Hebb則を実現する分子的な実体としては,シナプス前細胞からのグルタミン酸放出と,シナプス後細胞の脱分極が同時に生じたときにだけ開口してCa2+を流入させるN-methyl-D-aspartate受容体(NMDA受容体)が知られている.先に述べた視覚系の回路再編成においてはNMDA受容体が必須であることが示されている.Shatzは,このHebb則に基づき,神経活動依存的な神経回路強化のルールは“fire together, wire together”であると述べている8).一方で,Shatzは,神経活動依存的なシナプス刈り込みのルールとして,入力が同期しておらず,弱いシナプス入力が刈り込まれると述べており,これを“Out-of-sync, lose your link”と言い表している8).NMDA受容体に基づいて,特定のシナプスを強化する仕組みについては,長期増強(long-term potentiation:LTP)に基づいて説明できる.一方で,同期していない,少数派のシナプス入力が発達過程で刈り込まれる仕組みについては,既知のメカニズムでは説明できない.
2. 発達期におけるシナプス競合とシナプス刈り込み
発達期におけるシナプスや神経突起の刈り込みに関する研究は,視覚系以外にもいくつかのモデル系で行われてきた.それらの研究から,シナプス刈り込みは,神経回路を強化する仕組み(LTPなど)が働かないことで生じる消極的な過程というわけではなく,積極的な刈り込みメカニズムの結果であることが明らかになってきた.異なるシナプス間に作用するシナプス競合の仕組みによって,一方のシナプスでのみ刈り込みのための分子機構が働くと考えられている.
神経筋接合部においては,発達初期には一つの筋線維に対して複数の運動ニューロン軸索が接続し,多重支配の状態にある.しかしながら,その後の再編成によって,最終的には単一の軸索のみが一つの筋線維を支配するようになる9).同様に,小脳の登上線維–プルキンエ細胞シナプスにおいても,発達初期には多数の登上線維が一つのプルキンエ細胞にシナプス結合しているが,その後,軸索の刈り込みによって単一の軸索のみが一つのプルキンエ細胞を支配するようになる10).
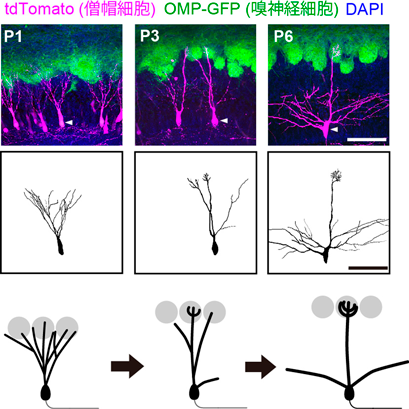
一方,マウス大脳皮質体性感覚野のバレル野において,第4層有棘星状細胞(以下,L4ニューロン)は,発達初期には複数のヒゲに対応する領域に樹状突起を伸ばしているが,その後,単一のヒゲに対応する領域(バレル)にのみ樹状突起を伸ばし,それ以外の領域に伸びていた樹状突起を刈り込む11).また,嗅球僧帽細胞も,発達初期には複数の糸球体に樹状突起を接続しているが,やがて,樹状突起刈り込みを経て,単一の糸球体にのみ樹状突起を接続するようになる12).
このように,シナプス刈り込みにおいては,軸索が刈り込まれる場合と樹状突起側が刈り込まれる場合とがある.しかしながら,シナプス後細胞に着目して考えると,実は共通した原理が働いているということがわかる.すなわち,いずれの例においても,一つのシナプス後細胞は,はじめ複数種類のシナプス入力を受け入れているが,最終的に,単一の種類のシナプス入力を残してそれ以外を刈り込む.その結果,たとえば感覚系では,それぞれシナプス後細胞の受容野(応答できる感覚入力の範囲)が徐々にチューニングされていく.したがって,シナプス刈り込みには,シナプス後細胞に入力する異なる種類のシナプス間で働く「シナプス競合」が関わっているものと考えられている.
シナプス競合の分子機構として,強いシナプス入力が入った際に,そのシナプスからそれ以外のシナプスに対して“punishment”シグナルが作用することで,刈り込みが生じるという仮説が提唱されてきた(図1)13).しかしながら,これまでにpunishmentシグナルの分子的な実体については明らかにされてこなかった.
このように,神経回路を作る仕組みや強化する仕組みはよく研究されてきたが,特定の回路を弱めて除去する仕組みについてはほとんどわかっていない.そこで筆者らは,嗅球の僧帽細胞に着目して,特定の神経接続を刈り込む仕組みの解明に取り組んできた.
嗅覚系においては,個々の嗅神経細胞は約1000種類ある嗅覚受容体の中から1種類のみを発現する(1ニューロン–1受容体ルール)14).また同じ種類の嗅覚受容体を発現する嗅神経細胞の軸索は嗅球上の同じ糸球体へと収斂する(1糸球体–1受容体ルール)15).糸球体では,僧帽細胞と房飾細胞が嗅神経細胞からのシナプス入力を受け取り,その情報を嗅皮質へと出力する.とりわけ僧帽細胞は嗅皮質の広い領域に投射している.100年以上前にGolgiやRamón y Cajalによって記述されているように,僧帽細胞は,成体においては単一の主樹状突起を単一の糸球体にのみ接続し,同時に数本の側方樹状突起を外網状層に伸ばす.主樹状突起が1本であるということ(1糸球体–1受容体ルール)が,単一の嗅覚受容体由来の入力に特化した僧帽細胞の受容野の基盤となっている12).一方,側方樹状突起はもっぱら抑制性のシナプス入力のみを受ける.僧帽細胞は,生後直後には多数の主樹状突起を複数の糸球体へと接続しているが,生まれて1週間以内に樹状突起の刈り込みを行うことで,単一の主樹状突起のみを単一の糸球体に接続するようになる(図2)16).これに伴い,僧帽細胞の受容野は,複数の嗅覚受容体に対応した匂いから,単一の嗅覚受容体に対応した匂いへと限局されていく.このように,僧帽細胞では,HubelとWieselが視覚系で観察したような受容野の精緻化が,明確な形態的変化を伴って生じるという特徴がある.そこで筆者らは,僧帽細胞は,シナプス刈り込みと受容野形成の研究をする上で,理想的なモデル系になりうると考えた.
4. 僧帽細胞樹状突起刈り込みにおける自発神経活動の役割
発達期のシナプス刈り込みは,一般的に神経活動依存的に生じると考えられている.しかしながら,僧帽細胞の樹状突起刈り込みに関しては,神経活動の関与について否定的な先行研究が多かった.たとえば,嗅神経細胞で嗅覚受容体が匂いを検出した後,神経活動を生じるのに必須な環状ヌクレオチド依存性チャネルCNGA2をノックアウトしたマウスでは,匂いを嗅ぐことができなくなったにもかかわらず,僧帽細胞樹状突起の刈り込みは正常に起こることが報告されていた17).また,嗅神経細胞由来のあらゆる神経活動を阻害した場合であっても,僧帽細胞の樹状突起刈り込みは正常であった18).そこで,筆者らは,僧帽細胞に内向き整流性カリウムチャネルKir2.1を過剰発現させ,僧帽細胞での神経活動を阻害する実験を行ったところ,樹状突起刈り込みが著しく損なわれることが判明した18).これらの結果は,嗅神経細胞からの入力によらない,自発的な神経活動が関与している可能性を示唆している.
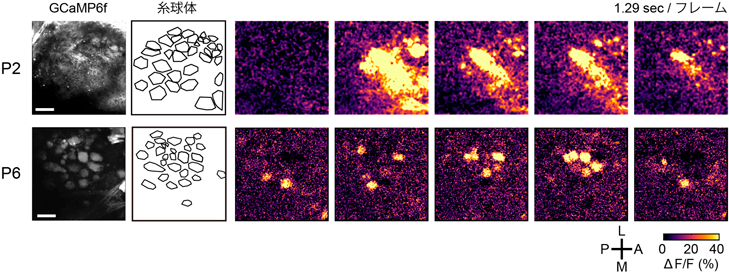
そこで,筆者らは,覚醒下の新生仔マウスにおいて,嗅球僧帽細胞のin vivoカルシウムイメージングを行ったところ,匂い刺激によらない,自発的な神経活動を見いだした19).生後1~2日目においては,多くの糸球体にまたがる同期的な自発神経活動が観察されたのに対し,生後3日目以降では,糸球体ごとに異なるタイミングで生じる自発神経活動が観察された(図3).
こうした自発神経活動は,嗅球の急性スライスにおいても観察された.このスライスを用いて薬理学的な解析を行ったところ,グルタミン酸の入力とギャップ結合が自発活動に必要であることが判明した.また,僧帽細胞でNMDA受容体をノックアウトすると樹状突起刈り込みが阻害されることも判明した.嗅球において,グルタミン酸作動性ニューロンは僧帽・房飾細胞しか存在しない.僧帽・房飾細胞は,軸索のみならず,樹状突起からもグルタミン酸を放出し,グルタミン酸のスピルオーバーを介して互いに活性化させることが知られている.そこで,僧帽・房飾細胞特異的に破傷風毒素軽鎖を発現させてグルタミン酸のスピルオーバーによる相互作用を阻害したところ,自発神経活動,樹状突起刈り込みともに阻害された.したがって,僧帽・房飾細胞の相互の活性化によって生じる自発神経活動が樹状突起刈り込みに関わっていると考えられる19).
発達期における視覚系の回路再編成には,網膜由来の自発神経活動(retinal waveとして知られる)が関わっていることが知られている20).聴覚系の回路再編成には,蝸牛の支持細胞や有毛細胞に由来する自発神経活動が関与することが知られている21).また,バレル野の回路再編成も,末梢由来の自発神経活動が関与すると報告されている22).このように,生後初期の神経回路再編成には,感覚入力よりもむしろ自発的な神経活動の方が普遍的に重要であると考えられる.もし,感覚入力のみを使って神経回路の再編成を行おうとすると,生涯で一度しか経験しないような匂いに対する回路を構築することは困難になるであろう.自発的な神経活動を用いることは,どの感覚入力に対応した神経回路も等しく構築することができるというメリットがある.
それでは,自発神経活動によって生じるグルタミン酸入力とNMDA受容体の活性化はどのようにして僧帽細胞樹状突起の再編成を制御しているのであろうか? NMDA受容体は,「勝者」となるシナプスの強化と,「敗者」となるシナプスの刈り込みの両方を制御している.
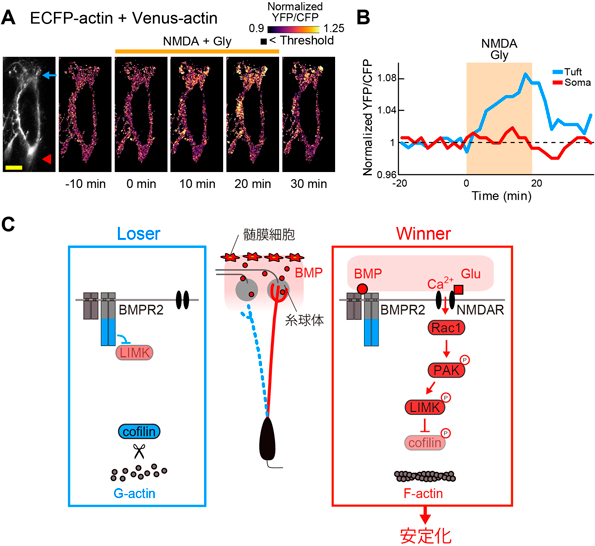
筆者らは,子宮内エレクトロポレーション法を用いたCRISPR-Cas9システムを用いて,僧帽細胞樹状突起の再編成を制御する分子のスクリーニングを行った.その中で,bone morphogenetic protein(BMP)の受容体の一つ,BMPR2の関与を明らかにした23).BMPR2をノックアウトすると,僧帽細胞の複数の樹状突起が安定化され,刈り込み異常が観察された.また,この異常は,細胞外のBMP結合ドメインを欠失したBMPR2を発現させてもレスキューされた.C末端の細胞内ドメインは,BMP非存在下でLIM kinase(LIMK)に結合し,その機能を阻害する働きを有する.一方,BMP存在下ではLIMKを解離し,そのシグナルを下流に伝える働きがある.BMPは嗅球表面の髄膜にのみ発現が観察されることから,髄膜に近い嗅球の糸球体ではBMPが豊富に存在すると考えられる.したがって,糸球体に伸びる樹状突起でのみ,LIMKが機能できるようにしている可能性が考えられる.
筆者らは,LIMKの活性制御についても明らかにした.NMDA受容体が活性化されると,Rac1が活性化される.Rac1はp21(RAC1)activated kinase 1(PAK)をリン酸化し,さらにリン酸化されたPAKが解離状体にあるLIMKをリン酸化する.さらに,リン酸化されたLIMKはcofilinをリン酸化する.cofilinは非リン酸化状態だとFアクチンの切断を行うが,リン酸化されるとその活性を失い,したがってFアクチンが安定化される.このことは,嗅球の急性スライスを用いたアクチンのFRETイメージングでも明らかになった(図4A, B).以上のことを踏まえると,BMPとグルタミン酸によるシナプス入力の双方が存在したときにのみ,僧帽細胞の樹状突起でアクチン重合が促進され,樹状突起が強化されると考えられる(図4C)23).
筆者らは,アクチン細胞骨格系に着目してさらに解析したところ,RhoAがNMDA受容体の下流で樹状突起刈り込みを制御していることを見いだした19).RhoA/B/Cをトリプルノックアウトすると樹状突起刈り込みが損なわれ,また,NMDA受容体ノックアウトによる樹状突起刈り込み異常は,RhoAの過剰発現によってレスキューされる.RhoAは,アクチン細胞骨格系を不安定化させることで神経突起の縮退に関与することが知られている.しかし,NMDA受容体によってRhoAが活性化し,樹状突起が刈り込まれるというシナリオは,よく考えてみると不思議である.NMDA受容体は勝者となるべき樹状突起に多く存在している一方,敗者のみを刈り込むためには,RhoAはNMDA受容体がほとんど存在しない,敗者でのみ活性化されなければならない.どのようにしてNMDA受容体は離れた樹状突起にあるRhoAのみを活性化させることができるのだろうか?
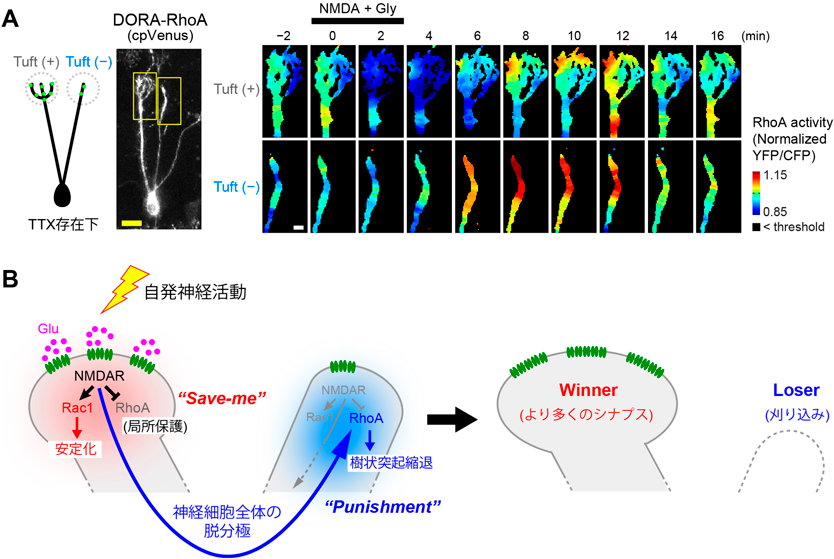
この疑問に答えるため,筆者らは嗅球の急性スライスを用いて,NMDAR受容体活性化に伴うRhoAの活性の変化を計測した(図5A).RhoAのFRETバイオセンサーDORA-RhoAを僧帽細胞に発現させ,十分に枝分かれをしており,勝者となりつつある樹状突起(Tuft(+))と,枝が少なく敗者となりつつある樹状突起(Tuft(−))とを有する僧帽細胞に着目して観察した.ここでは,NMDA受容体を豊富に有するグルタミン酸作動性シナプスは主にTuft(+)の樹状突起に存在するため,NMDAを灌流することで,主にTuft(+)でのみNMDA受容体を活性化させることができる.その結果,NMDA受容体の入力があるTuft(+)樹状突起ではRhoAが強く抑制される一方,細胞体やTuft(−)樹状突起ではRhoAが活性化されることが判明した(図5A).一方,高カリウム溶液で神経細胞全体を脱分極させた場合には,すべての樹状突起および細胞体でRhoAの活性化が観察された.
これらのことから,NMDA受容体はRhoAに対して2通りのまったく異なる制御を行っているものと考えられる(図5B)19).NMDA受容体が活性化され,神経細胞が脱分極すると,脱分極刺激に応じてRhoAが活性化し,アクチン細胞骨格系の不安定化を通して刈り込みを促進する.このような作用こそが,古くから提唱されていた,シナプス入力依存的なpunishmentシグナルの実体であると考えられる.入力のあったシナプスからそれ以外のシナプスに遠隔作用する側方抑制ともいえる.一方で,活性化されたNMDA受容体の近傍では別のシグナルが働き,RhoAの抑制を行う.これによって,その樹状突起だけは刈り込みから保護される.これは,punishmentシグナルが異なるシナプスにのみ作用するための局所保護機構(save-meシグナル)の実体であると考えられる.
現在のところ,NMDA受容体がその近傍と遠位部とでRhoAに対してまったく逆の作用を及ぼす仕組みはよくわかっていない.RhoAの活性化については,脱分極刺激依存的に神経細胞全体でRhoGEFが活性化されることによって生じると考えられる.一方,一部のRhoGAPはNMDA受容体の近傍でのみ作用する仕組みがあり,局所的なRhoAの抑制と樹状突起保護に働いている可能性が考えられる.
7. なぜout-of-syncだとシナプス刈り込みが促進されるのか?
Shatzは,神経活動依存的なシナプス刈り込みは“Out-of-sync, lose your link”であると述べている8).実際に,嗅球でも,発達初期には複数の糸球体にまたがって同期した活動がみられるが,より後期になると,糸球体ごとに異なるタイミングで自発発火するようになる.では,“Out-of-sync, lose your link”は筆者らのモデルでどのように説明されるだろうか.
筆者らは,NMDA受容体が活性化されると,その近傍で刈り込みの抑制(RhoAの抑制)がかかることを見いだした.したがって,すべての神経突起で同時にNMDA受容体が活性化されると,すべての神経突起が刈り込み抑制を受けることとなり,刈り込みは生じない.一方,仮に複数の樹状突起に十分量のNMDA受容体が存在したとしても,シナプス入力が非同期の場合は,シナプス入力があった樹状突起でしか刈り込み抑制が起こらないため,それ以外の樹状突起にはpunishmentシグナル(RhoA活性化)が送られる.自発神経活動は繰り返し起こるため,互いにこうした側方抑制を送ることができれば,はじめほぼ同じ強度のシナプス入力を受けていたシナプスの間にも競合が生じ,いずれは1種類の勝者以外のすべてのシナプスを刈り込むことができると考えられる.
筆者らは,我々が僧帽細胞で見いだしたのと同じ機構が,大脳皮質バレル野L4ニューロンの樹状突起刈り込みにも関与していることを見いだした.RhoAをノックアウトすると,バレルの外に伸びた樹状突起を刈り込むことができなくなる19).しかし,バレル野のL4ニューロンは,僧帽細胞とは異なり,樹状突起が必ずしも1本になるわけではない.どうしてバレル野では複数の樹状突起が安定化されるのであろうか? このヒントは,発達期に生じる自発神経活動のパターンにある.バレル野では,神経回路再編成の起こる新生仔期において,各ヒゲに対応したバレルごとに同期したシナプス入力が生じる.したがって,同一のバレルに接続している複数の樹状突起は常にfire togetherとなるのである.そうすると,これらの間での側方抑制は働かないことになる.その結果,バレル外に伸びる樹状突起は刈り込まれる一方で,バレル内にある樹状突起はいずれも刈り込まれずに残ることになる.このように,シナプス刈り込みのための側方抑制は,異なる種類の入力を受けるシナプスの間でのみ働くこととなり,結果的に,ニューロンは特定の種類の入力にチューニングされた受容野を獲得することができるのである.
近年,シナプス刈り込みにはミクログリアをはじめとするグリアによる貪食が関与するという説が唱えられている24).あたかもグリアがシナプス刈り込みの主役であるかのような主張も多い25).筆者らとしても,こうした主張を無視するわけにもいかないので,ミクログリアの関与について検討を行った.
発達期のミクログリアを除去するため,ミクログリアの生存に必要なcolony stimulating factor 1 receptor(CSF1R)の阻害剤であるPLX5622を胎生12日目から母体に投与した.生後は仔に直接投与した.これにより,90%以上のミクログリアを除去することができた.しかしながら,僧帽細胞樹状突起の刈り込みにはまったく影響がみられなかった26).同様に,バレル野L4ニューロンの樹状突起刈り込みにもまったく影響は確認できなかった26).このことから,発達期の樹状突起刈り込みにはミクログリアは必要ないと考えられる.
その後,少なくとも三つのグループから異なる回路で同様の結果が報告されており,ミクログリアが発達期のシナプス除去に関与する可能性についてはいずれも否定的である27–29).ミクログリアが炎症や損傷に伴うシナプス刈り込みに関与する可能性については多くの証拠があるが,正常な脳発達の過程で積極的に神経突起やシナプスの刈り込みを制御しているかは疑問である.あくまでも,神経活動依存的なシナプス刈り込みの主役はシナプス後細胞で生じるシナプス競合であり,仮にグリアが何らかの関与をしているとしても,補助的な役割にすぎないと考えられる.
本稿では,筆者がこれまでに取り組んできた僧帽細胞樹状突起の刈り込みにフォーカスして,シナプス競合とシナプス刈り込みのメカニズムについて論じた.発達期の神経回路再編成においては,特定のシナプスの強化のみならず,刈り込みも同じように重要である.にもかかわらず,これまでシナプス刈り込みのメカニズムに関する理解は遅れていた.我々の研究から,シナプス入力によって生じるNMDA受容体の活性化によって,局所的なRhoAの抑制による保護機構と,ニューロン全体にわたるRhoAの活性化による側方抑制の組合わせによって,敗者となるべき樹状突起のみ刈り込まれることが明らかとなった.今後は,NMDA受容体に依存した局所的なRhoAの抑制と,遠位部でのRhoAの活性化の仕組みを明らかにすることが,重要な課題である.
筆者らの研究では,僧帽細胞と同様の仕組みがバレル野のL4ニューロンの樹状突起刈り込みにも関与していることを明らかにした.しかしながら,それ以外の系でも同様の仕組みがシナプス刈り込みを制御しているのかは不明である.特に,神経筋接合部や登上線維–プルキンエシナプスでは,少なくとも成体ではNMDA受容体は機能していないと考えられている.幼若期にはNMDA受容体が関与しているのか,それとも同等の機能を有する別の分子が関与しているのかについては今後検討する必要がある.また,これらの例では,シナプス後細胞におけるシナプス競合の結果,シナプス前部を有する軸索の刈り込みが生じる.軸索の刈り込みには,最近JAK2/STAT1やspastinなどの分子が関与することが知られており30, 31),RhoAなどシナプス後細胞のpunishmentシグナルとの関連についても,今後の研究が待たれる.さらに,シナプス除去は,発達期のみならず,学習・記憶にも関わっていることが示されている32, 33).神経回路は,発達期に最もダイナミックな再編成を受けるが,大人になったら完成というわけでは決してない.神経回路は環境への適応や学習の過程でも絶えず再編成されており,それによって新たな脳機能が獲得される.したがって,神経回路は,その再編成過程こそがその本質であるといっても過言ではない.今後は,細胞レベルの再編成からネットワークレベルの機能表出につながる原理の解明も大きな課題となるであろう.
謝辞Acknowledgments
本稿で紹介したのは筆者の研究室で過去10年以上にわたって行われた研究の成果であり,これまでの研究室メンバーに感謝したい.
引用文献References
1) Goodman, C.S. & Shatz, C.J. (1993) Developmental mechanisms that generate precise patterns of neuronal connectivity. Cell, 72(Suppl), 77–98.
2) Tessier-Lavigne, M. & Goodman, C.S. (1996) The molecular biology of axon guidance. Science, 274, 1123–1133.
3) Siddiqui, T.J. & Craig, A.M. (2011) Synaptic organizing complexes. Curr. Opin. Neurobiol., 21, 132–143.
4) Wiesel, T.N. & Hubel, D.H. (1963) Single-cell responses in striate cortex of kittens deprived of vision in one eye. J. Neurophysiol., 26, 1003–1017.
5) Wiesel, T.N. & Hubel, D.H. (1965) Comparison of effects of unilateral and bilateral eye closure on cortical unit responses in kittens. J. Neurophysiol., 28, 1029–1040.
6) Penn, A.A., Riquelme, P.A., Feller, M.B., & Shatz, C.J. (1998) Competition in retinogeniculate patterning driven by spontaneous activity. Science, 279, 2108–2112.
7) Hebb, D.O. (1949) The Organization of Behavior: A Neuropsychological Theory. John Wiley and Sons, New York.
8) Shatz, C.J. (1992) The developing brain. Sci. Am., 267, 60–67.
9) Sanes, J.R. & Lichtman, J.W. (1999) Development of the vertebrate neuromuscular junction. Annu. Rev. Neurosci., 22, 389–442.
10) Watanabe, M. & Kano, M. (2011) Climbing fiber synapse elimination in cerebellar Purkinje cells. Eur. J. Neurosci., 34, 1697–1710.
11) Mizuno, H., Luo, W., Tarusawa, E., Saito, Y.M., Sato, T., Yoshimura, Y., Itohara, S., & Iwasato, T. (2014) NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron, 82, 365–379.
12) Imai, T. (2014) Construction of functional neuronal circuitry in the olfactory bulb. Semin. Cell Dev. Biol., 35, 180–188.
13) Lichtman, J.W. & Colman, H. (2000) Synapse elimination and indelible memory. Neuron, 25, 269–278.
14) Serizawa, S., Miyamichi, K., & Sakano, H. (2004) One neuron-one receptor rule in the mouse olfactory system. Trends Genet., 20, 648–653.
15) Mori, K. & Sakano, H. (2011) How is the olfactory map formed and interpreted in the mammalian brain? Annu. Rev. Neurosci., 34, 467–499.
16) Malun, D. & Brunjes, P.C. (1996) Development of olfactory glomeruli: Temporal and spatial interactions between olfactory receptor axons and mitral cells in opossums and rats. J. Comp. Neurol., 368, 1–16.
17) Lin, D.M., Wang, F., Lowe, G., Gold, G.H., Axel, R., Ngai, J., & Brunet, L. (2000) Formation of precise connections in the olfactory bulb occurs in the absence of odorant-evoked neuronal activity. Neuron, 26, 69–80.
18) Ma, L., Wu, Y.M., Qiu, Q., Scheerer, H., Moran, A., & Yu, C.R. (2014) A developmental switch of axon targeting in the continuously regenerating mouse olfactory system. Science, 344, 194–197.
19) Fujimoto, S., Leiwe, M.N., Aihara, S., Sakaguchi, R., Muroyama, Y., Kobayakawa, R., Kobayakawa, K., Saito, T., & Imai, T. (2023) Activity-dependent local protection and lateral inhibition control synaptic competition in developing mitral cells in mice. Dev. Cell, 58, 1221–1236.e7.
20) Meister, M., Wong, R.O.L., Baylor, D.A., & Shatz, C.J. (1991) Synchronous bursts of action-potentials in ganglion-cells of the developing mammalian retina. Science, 252, 939–943.
21) Tritsch, N.X., Yi, E.Y., Gale, J.E., Glowatzki, E., & Bergles, D.E. (2007) The origin of spontaneous activity in the developing auditory system. Nature, 450, 50–55.
22) Mizuno, H., Ikezoe, K., Nakazawa, S., Sato, T., Kitamura, K., & Iwasato, T. (2018) Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Rep., 22, 123–135.
23) Aihara, S., Fujimoto, S., Sakaguchi, R., & Imai, T. (2021) BMPR-2 gates activity-dependent stabilization of primary dendrites during mitral cell remodeling. Cell Rep., 35, 109276.
24) Stevens, B., Allen, N.J., Vazquez, L.E., Howell, G.R., Christopherson, K.S., Nouri, N., Micheva, K.D., Mehalow, A.K., Huberman, A.D., Stafford, B., et al. (2007) The classical complement cascade mediates CNS synapse elimination. Cell, 131, 1164–1178.
25) Faust, T.E., Gunner, G., & Schafer, D.P. (2021) Mechanisms governing activity-dependent synaptic pruning in the developing mammalian CNS. Nat. Rev. Neurosci., 22, 657–673.
26) Niiyama, T., Fujimoto, S., Imai, T. (2023) Microglia are dispensable for developmental dendrite pruning of mitral cells in mice. eNeuro, 10, ENEURO.0323–23.2023.
27) Brown, T.C., Crouse, E.C., Attaway, C.A., Oakes, D.K., Minton, S.W., Borghuis, B.G., & McGee, A.W. (2024) Microglia are dispensable for experience-dependent refinement of mouse visual circuitry. Nat. Neurosci., 27, 1462–1467.
28) O’Keeffe, M., Booker, S.A., Walsh, D., Li, M., Henley, C., Simões de Oliveira, L., Liu, M., Wang, X., Banqueri, M., Ridley, K., et al. (2025) Typical development of synaptic and neuronal properties can proceed without microglia in the cortex and thalamus. Nat. Neurosci., 28, 268–279.
29) Surala, M., Soso-Zdravkovic, L., Munro, D., Rifat, A., Ouk, K., Vida, I., Priller, J., & Madry, C. (2024) Lifelong absence of microglia alters hippocampal glutamatergic networks but not synapse and spine density. EMBO Rep., 25, 2348–2374.
30) Brill, M.S., Kleele, T., Ruschkies, L., Wang, M.Z., Marahori, N.A., Reuter, M.S., Hausrat, T.J., Weigand, E., Fisher, M., Ahles, A., et al. (2016) Branch-specific microtubule destabilization mediates axon branch loss during neuromuscular synapse elimination. Neuron, 92, 845–856.
31) Yasuda, M., Nagappan-Chettiar, S., Johnson-Venkatesh, E.M., & Umemori, H. (2021) An activity-dependent determinant of synapse elimination in the mammalian brain. Neuron, 109, 1333–1349.e6.
32) Cichon, J. & Gan, W.B. (2015) Branch-specific dendritic Ca spikes cause persistent synaptic plasticity. Nature, 520, 180–185.
33) Hedrick, N.G., Wright, W.J., & Komiyama, T. (2024) Local and global predictors of synapse elimination during motor learning. Sci. Adv., 10, eadk0540.
34) Imai, T. (2025) Activity-dependent synaptic competition and dendrite pruning in developing mitral cells. Front. Neural Circuits, 19, 1541926.
著者紹介Author Profile
 今井 猛(いまい たけし)
今井 猛(いまい たけし)九州大学大学院医学研究院 教授(主幹教授).博士(理学)(東京大学).
略歴2001年東京大学理学部卒業,06年同大学院理学系研究科修了(指導教員:坂野仁).09年よりさきがけ研究者,10年より理化学研究所発生・再生科学総合研究センターチームリーダー,17年より現職.
研究テーマと抱負機能的な神経回路が発達過程で形作られる仕組みについて研究してきた.その過程で,神経回路を可視化するための標識方法や組織透明化法の開発にも取り組んできた.2024年より,学術変革領域(A)「動的コネクトームに基づく脳機能創発機構の解明」(https://plaza.umin.ac.jp/dynamic-brain/)領域代表.
ウェブサイトhttps://www.lab.med.kyushu-u.ac.jp/dn/
趣味サッカー観戦,ピアノ,釣り.