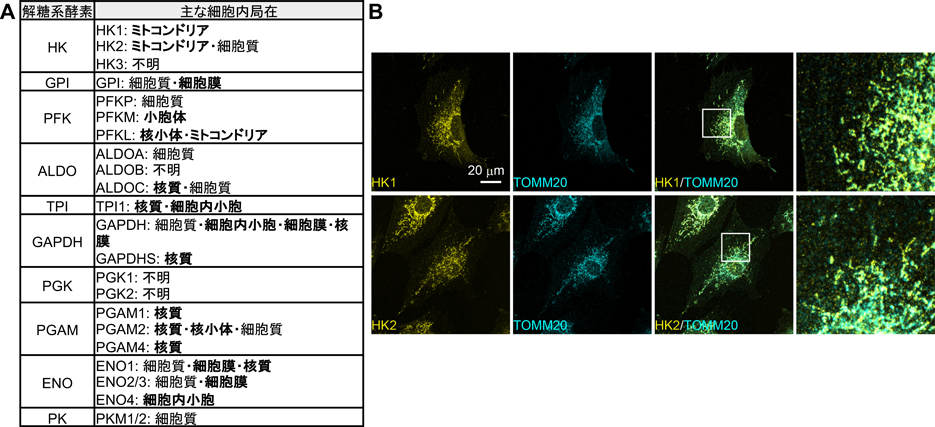
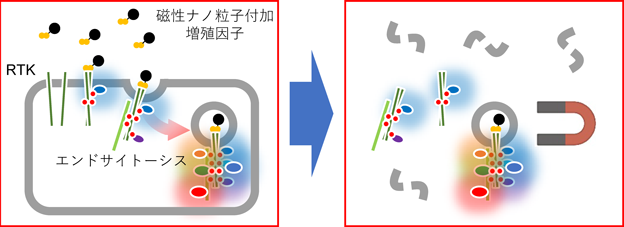
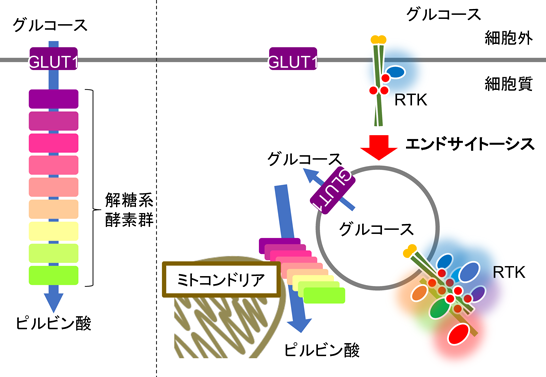
受容体型チロシンキナーゼのエンドサイトーシスによる細胞の糖代謝制御Regulation of carbohydrate metabolism through endocytosis of receptor-type tyrosine kinases
北里大学医学部生化学Department of Biochemistry, Kitasato University School of Medicine ◇ 〒252–0374 神奈川県相模原市南区北里1–15–1 ◇ 1–15–1 Kitasato, Minami-ku, Sagamihara, Kanagawa 252–0374, Japan