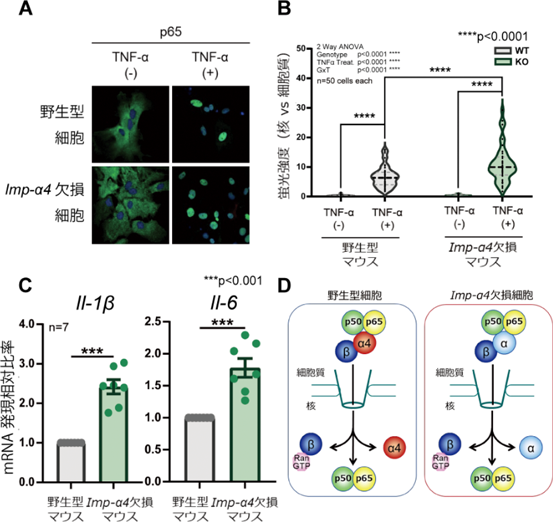
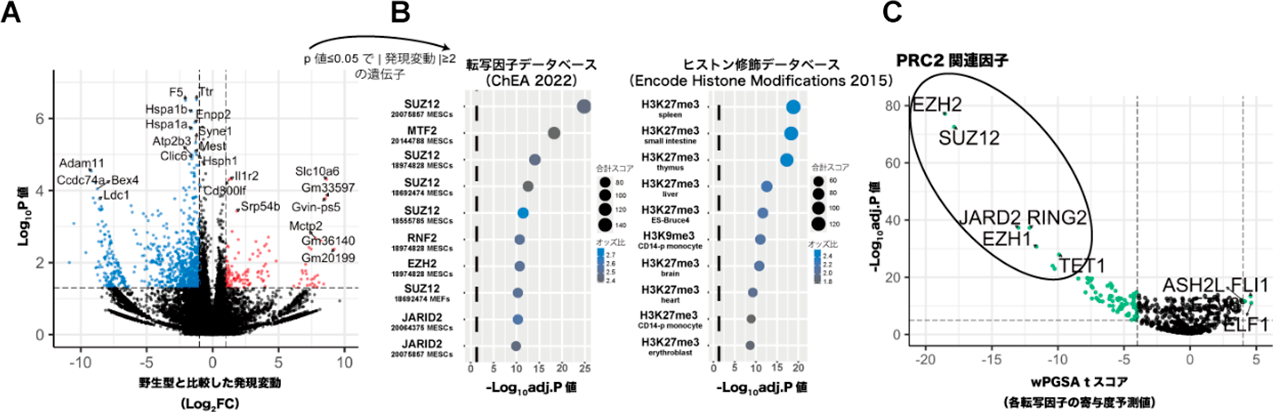
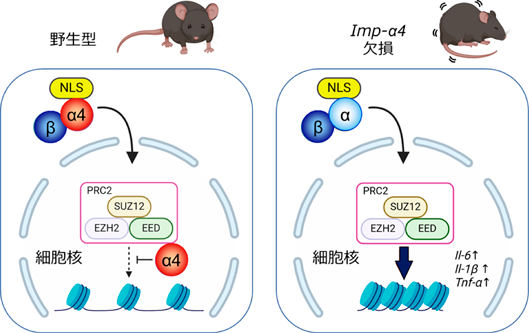
核輸送分子Importin αの多機能性からさぐる高次脳機能Importin α4 knockout mouse exhibits psychiatric disorder-related behavioral deficits and neuroinflammation
1 国立研究開発法人医薬基盤・健康・栄養研究所生体機能分子制御プロジェクトLaboratory of Biofunctional Molecular Medicine, National Institutes of Biomedical Innovation, Health and Nutrition (NIBN) ◇ 〒567–0085 大阪府茨木市彩都あさぎ7–6–8 ◇ Saito-asagi 7–6–8, Ibaraki, Osaka 567–0085, Japan
2 エアランゲン大学医学部Laboratory of Neural Epigenomics, Faculty of Medicine, FAU Erlangen ◇ Kussmaulallee 2, 91054 Erlangen, Germany ◇ Kussmaulallee 2, 91054 Erlangen, Germany
3 大阪大学蛋白質研究所高次脳機能学研究室Laboratory for Advanced Brain Functions, Institute for Protein Research, The University of Osaka ◇ 〒565–0871 大阪府吹田市山田丘3–2 ◇ 3–2 Yamadaoka, Suita, Osaka 565–0871, Japan