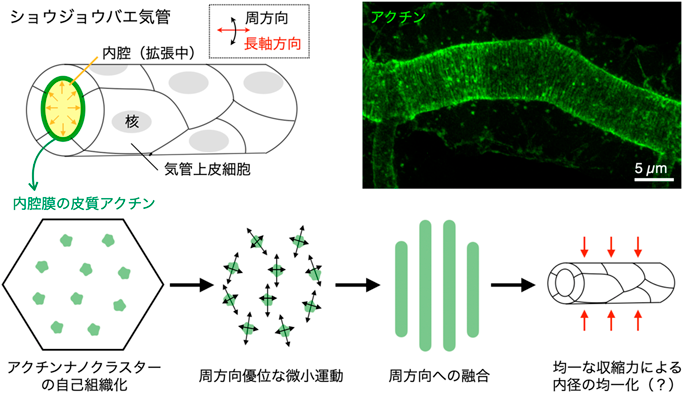
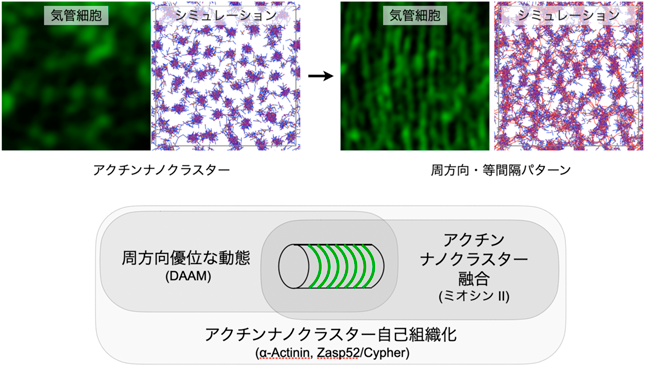
管状組織におけるアクチンナノクラスターによる周方向・等間隔パターン自己組織化機構Actin nanoclusters as organizing centers for circumferential periodic patterns in tubular tissues
東京科学大学総合研究院細胞制御工学センターInstitute of Science Tokyo, Institute of Integrated Research, Cell Biology Center ◇ 〒226–8503 神奈川県横浜市緑区長津田町4259 ◇ 4259 Nagatsutacho, Midori-ku, Yokohama, Kanagawa 226–8503, Japan