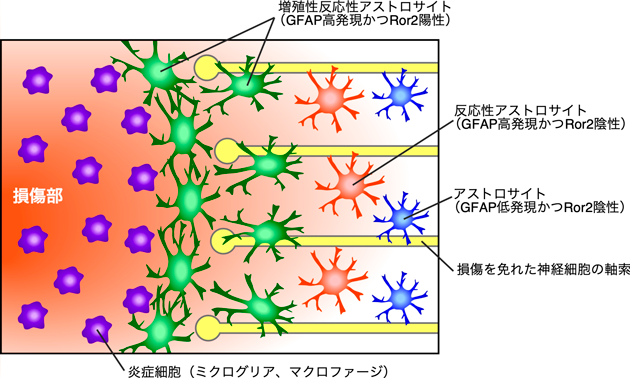
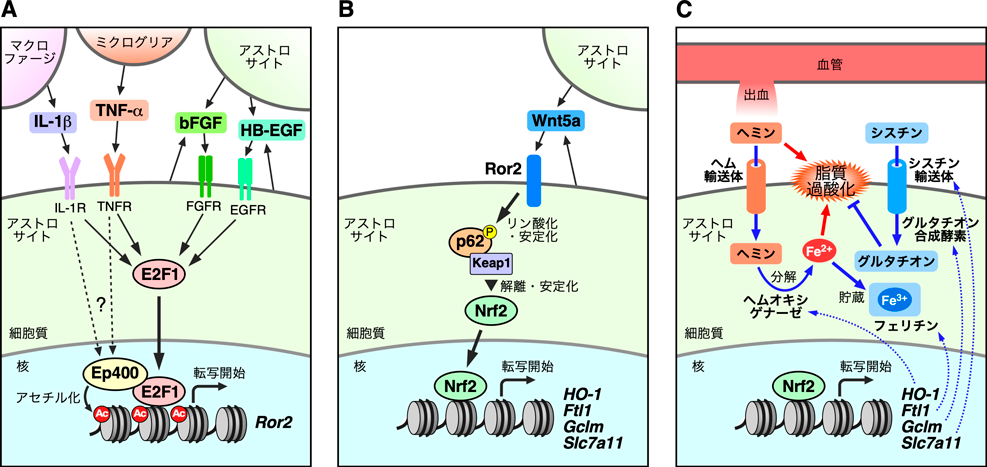
Wnt5a–Ror2シグナルを介する反応性アストロサイトの神経保護機構Neuroprotective mechanism of reactive astrocytes via Wnt5a–Ror2 signaling
神戸大学大学院医学研究科細胞生理学分野Division of Cell Physiology, Graduate School of Medicine, Kobe University ◇ 〒650–0017 神戸市中央区楠木町7–5–1 ◇ 7–5–1 Kusunoki-cho, Chuo-ku, Kobe 650–0017, Japan