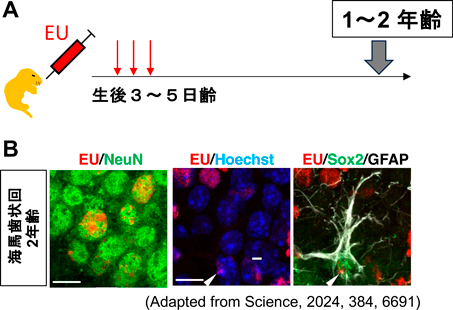
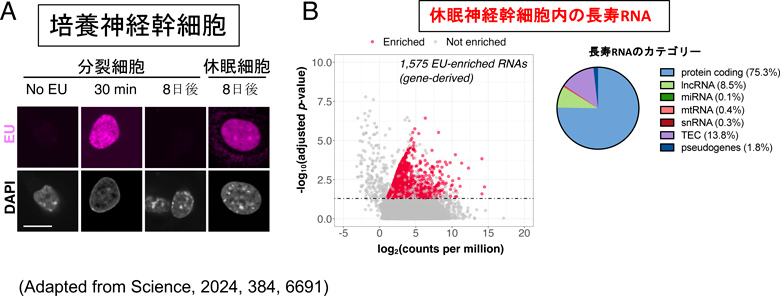
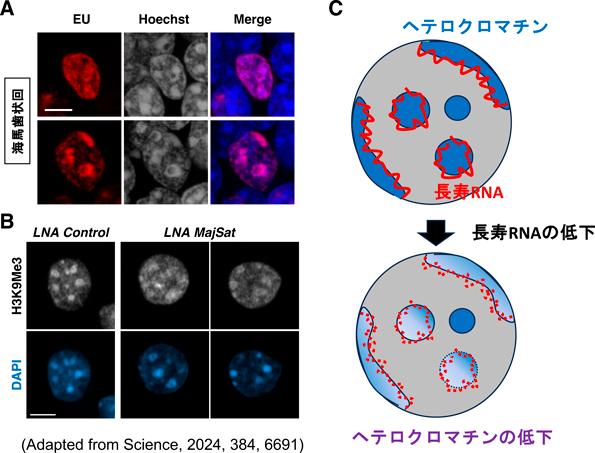
げっ歯類の脳において生涯維持される核内RNAの機能Long-lived RNAs in the rodent brain
エアランゲン大学医学部/マックスプランク医学物理学研究センターFriedrich-Alexander Universität Erlangen-Nürnberg/Max-Planck-Zentrum für Physik und Medizin ◇ Kussmaulallee 2, 91054 Erlangen, Germany ◇ Kussmaulallee 2, 91054 Erlangen, Germany