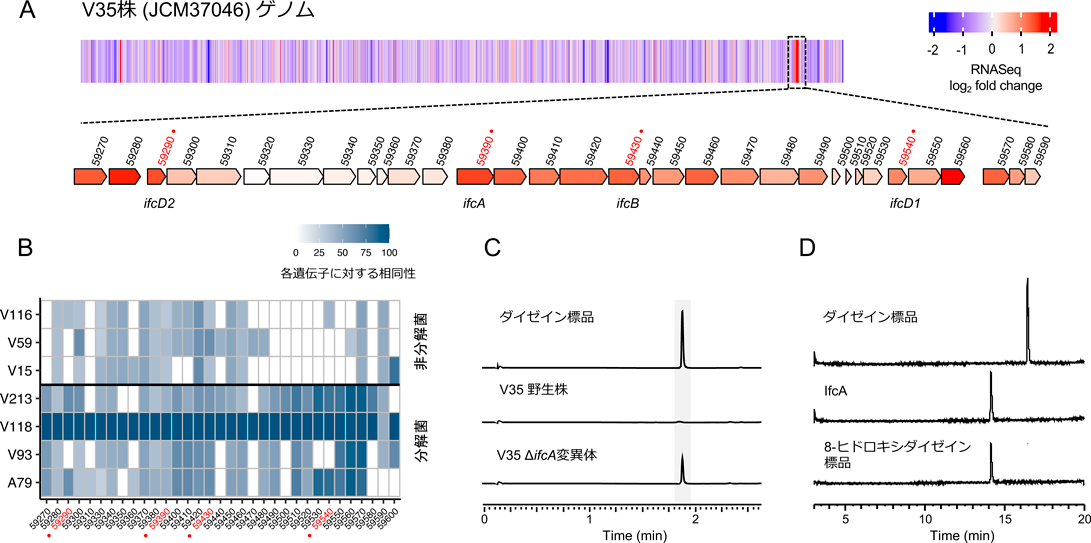
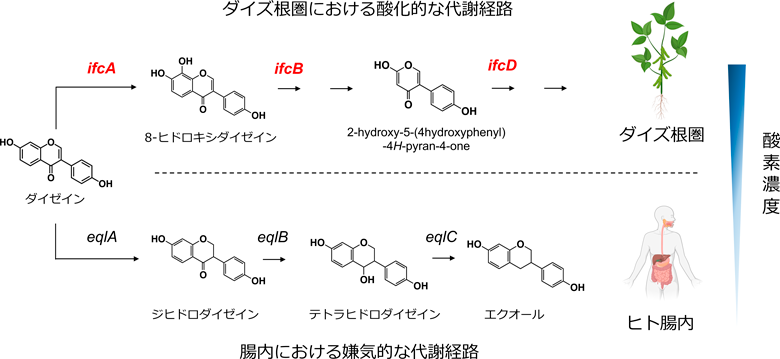
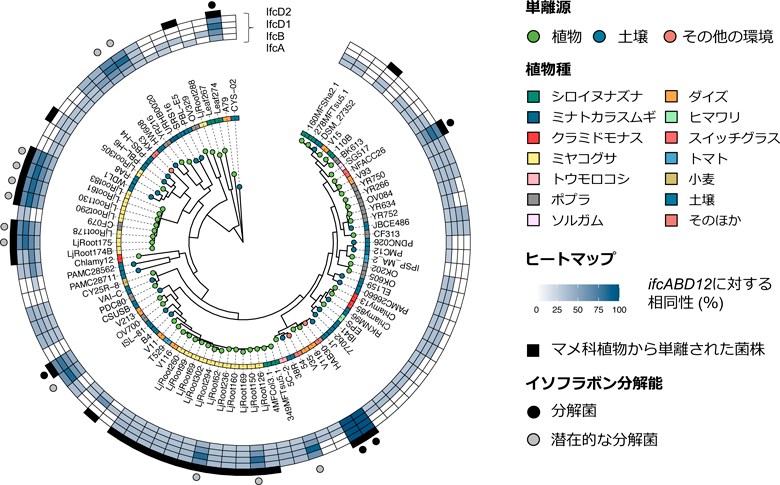
ダイズ根圏細菌から見いだした新しいイソフラボン代謝経路Novel isoflavone catabolism pathway identified from soybean rhizosphere bacteria
1 北海道大学理学研究院Faculty of Science, Hokkaido University ◇ 〒060–0810 北海道札幌市北区北10条西8丁目 ◇ Kita-10 Nishi-8, Kita-ku, Sapporo, Hokkaido 060–0810, Japan
2 京都大学生存圏研究所Research Institute for Sustainable Humanosphere (RISH), Kyoto University ◇ 〒611–0011 京都府宇治市五ケ庄 ◇ Gokasho, Uji, Kyoto 611–0011, Japan