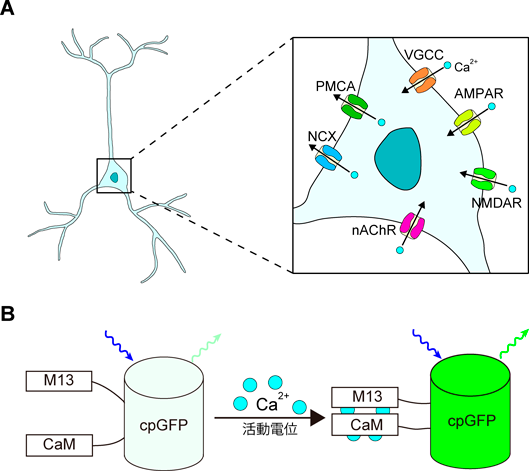
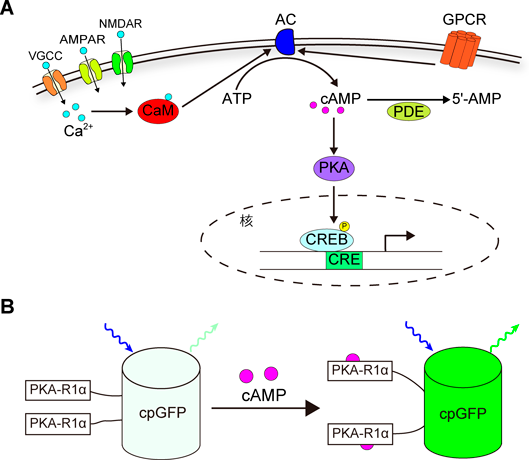
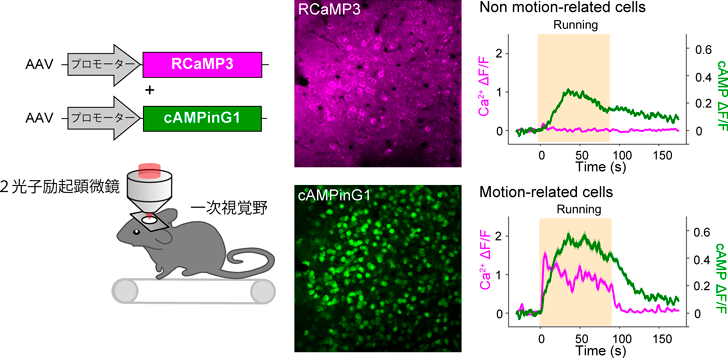
Ca2+とcAMPのライブイメージングからひもとく脳機能Elucidating brain functions with live imaging of Ca2+ and cAMP
京都大学大学院生命科学研究科生命情報解析教育センターCenter for Living Systems Information Science, Graduate School of Biostudies, Kyoto University ◇ 〒606–8507 京都府京都市左京区聖護院川原町53 ◇ 53 Shogoin Kawara-cho, Sakyo-ku, Kyoto 606–8507, Japan