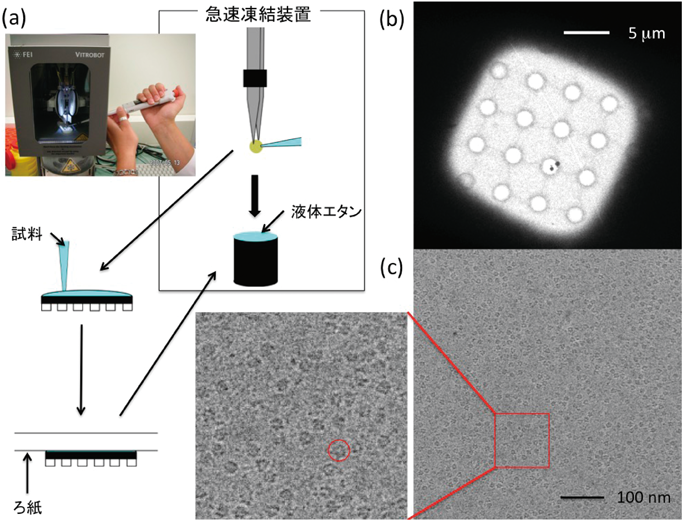
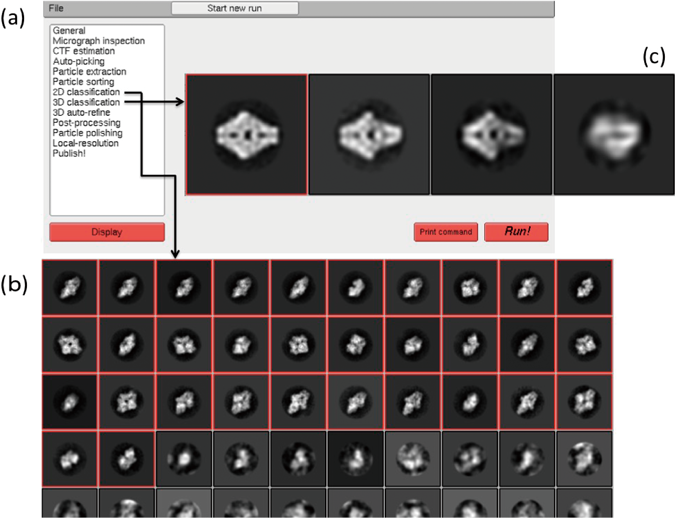
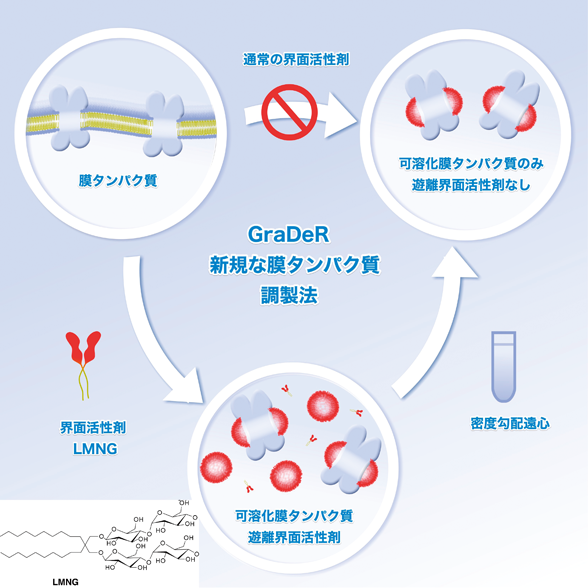
2) McMullan, G., Faruqi, A.R., Henderson, R., Guerrini, N., Turchetta, R., Jacobsm, A., & Van Hoften, G. (2009) Ultramicroscopy, 109, 1144–1147.
3) Miyazaki, N. & Murata, K.(2013)顕微鏡,48, 57–60.
4) Li, X., Mooney, P., Zheng, S., Booth, C.R., Braunfeld, M.B., Gubbens, S., Agard, D.A., & Cheng, Y. (2013) Nat. Methods, 10, 584–590.
8) Nguyen, T.H.D., Galej, W.P., Bai, X., Oubridge, C., Newman, A.J., Scheres, S.H.W., & Nagai, K. (2016) Nature, 530, 298–302.
9) Kanno, R., Koike-Takeshita, A., Yokoyama, K., Taguchi, H., & Mitsuoka, K. (2009) Structure, 17, 287–293.
11) Merk, A., Bartesaghi, A., Banerjee, S., Falconieri, V., Rao, P., Davis, M.I., Pragani, R., Boxer, M.B., Earl, L.A., Milne, J.L., & Subramaniam, S. (2016) Cell, 165, 1698–1707.
13) Lu, P., Bai, X.C., Ma, D., Xie, T., Yan, C., Sun, L., Yang, G., Zhao, Y., Zhou, R., Scheres, S.H., & Shi, Y. (2014) Nature, 512, 166–170.
14) Popot, J.L., Althoff, T., Bagnard, D., Banères, J.L., Bazzacco, P., Billon-Denis, E., Catoire, L.J., Champeil, P., Charvolin, D., Cocco, M.J., Crémel, G., Dahmane, T., de la Maza, L.M., Ebel, C., Gabel, F., Giusti, F., Gohon, Y., Goormaghtigh, E., Guittet, E., Kleinschmidt, J.H., Kühlbrandt, W., Le Bon, C., Martinez, K.L., Picard, M., Pucci, B., Sachs, J.N., Tribet, C., van Heijenoort, C., Wien, F., Zito, F., & Zoonens, M. (2011) Annu. Rev. Biophys., 40, 379–408.
15) Hauer, F., Gerle, C., Fischer, N., Oshima, A., Shinzawa-Itoh, K., Shimada, S., Yokoyama, K., Fujiyoshi, Y., & Stark, H. (2015) Structure, 23, 1769–1775.