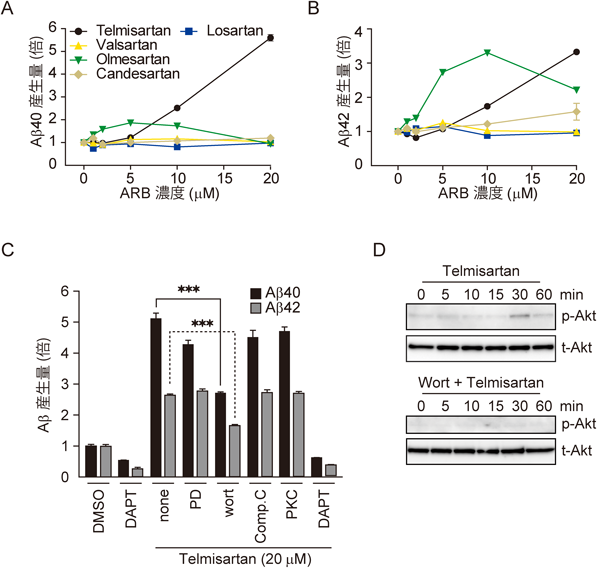
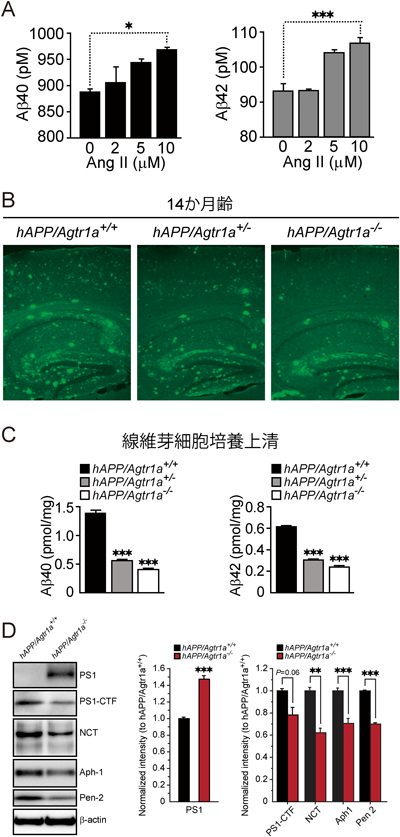
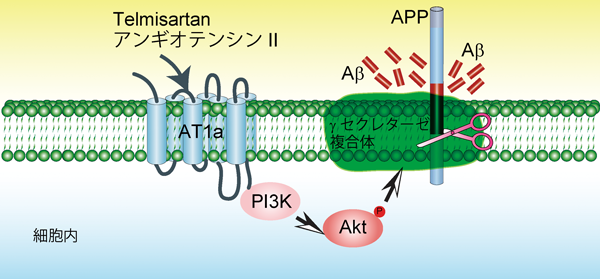
アンギオテンシン受容体とアミロイドβタンパク質産生Regulation of Aβ production by angiotensin receptor type Ia
岩手医科大学薬学部神経科学講座Department of Neuroscience, School of Pharmacy, Iwate Medical University ◇ 〒028–3694 岩手県紫波郡矢巾町西徳田2–1–1 ◇ 2–1–1 Nishitokuta, Yahaba, Iwate 028–3694, Japan