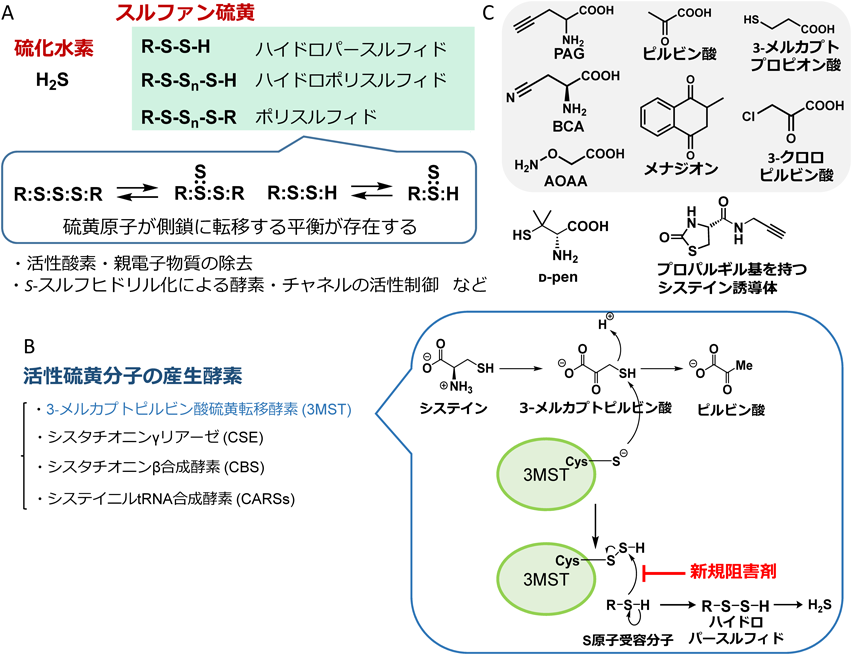
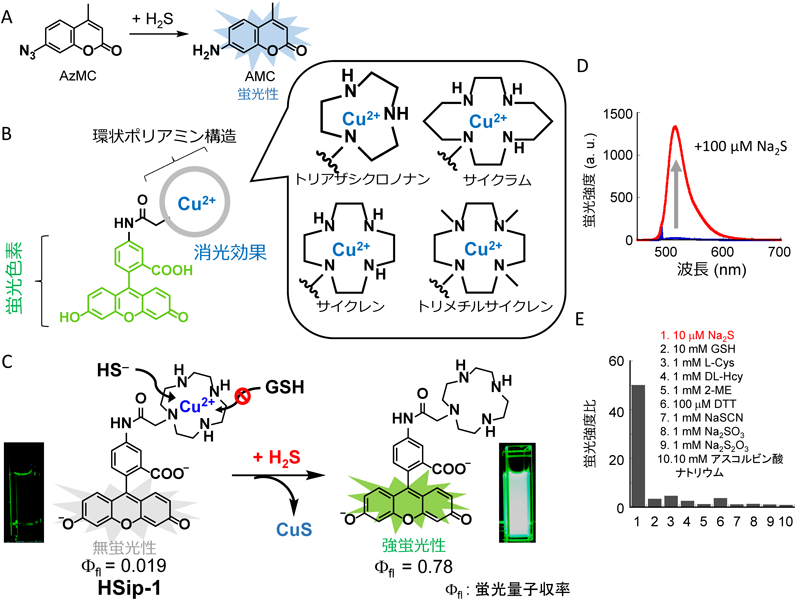
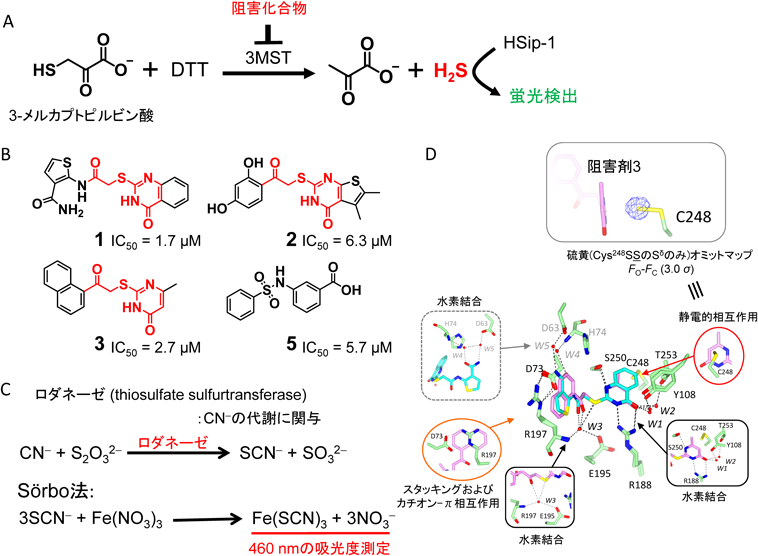
活性硫黄分子産生酵素に対する新規阻害剤の開発Development of a novel inhibitor for reactive sulfur species-producing enzymes
東京大学大学院薬学系研究科薬品代謝化学教室Graduate School of Pharmaceutical Sciences, The University of Tokyo ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ 7–3–1, Hongo, Bunkyo-ku, Tokyo 113–0033 Japan