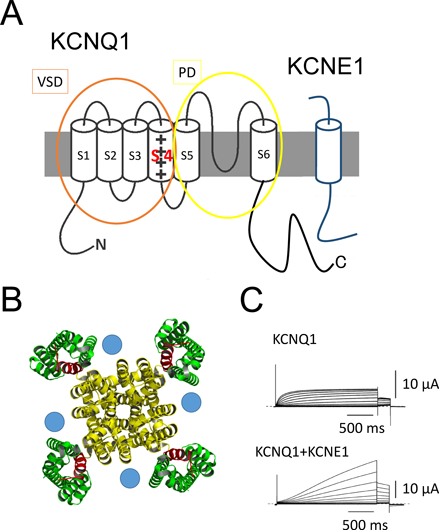
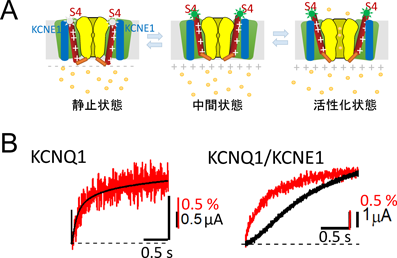
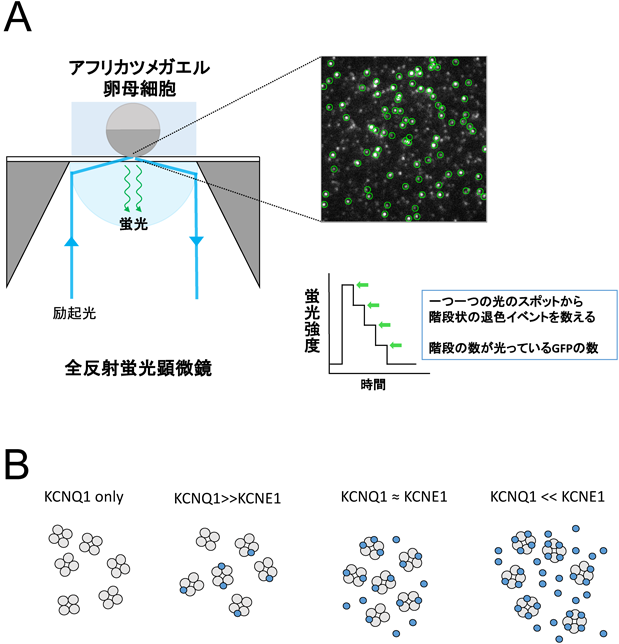
心臓のリズムを刻むイオンチャネル複合体の“複雑な”制御Complex regulation of KCNQ1 channel complex
自治医科大学医学部生理学講座統合生理学部門Division of Integrative Physiology, Department of Physiology, Jichi Medical University ◇ 〒329–0498栃木県下野市薬師寺3311–1 ◇ 3311–1 Yakushiji, Shimotsuke, Tochigi 329–0498, Japan