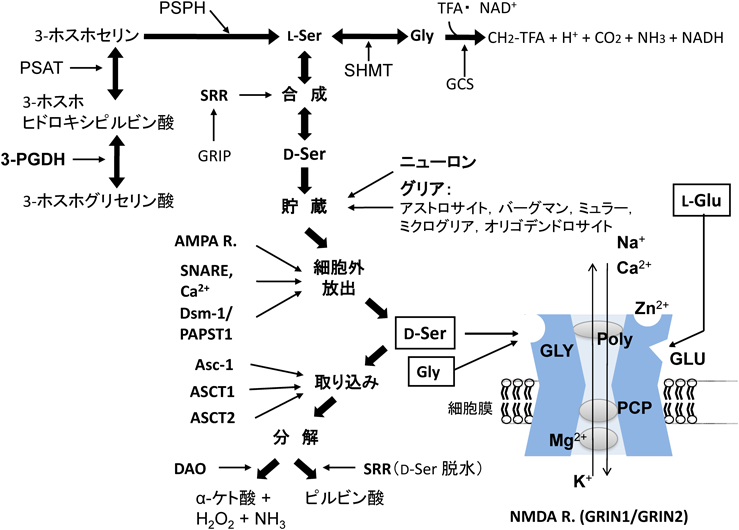
D-セリンは,興奮性アミノ酸伝達機構の研究において,古くから,NMDA型グルタミン酸受容体(NMDA受容体)のグリシン調節部位に選択的に作用し,グリシン・D-アラニンと並んで同受容体の活性化に必須のコアゴニストとして機能することが,in vitroの実験により知られていた1).NMDA受容体は,記憶・学習をはじめとする高次脳機能の発現・調節において中核的役割を果たすことが明らかにされていたが1),1983年に,統合失調症と区別が難しい精神症状を引き起こすフェンサイクリジン(phencyclidine:PCP)2)がNMDA受容体の強力な遮断薬であることが見いだされて以来3),同受容体の機能障害と精神疾患との関係が注目を集めるようになった4).
筆者ら5–7)は,D-セリンやD-アラニンが,毒性が低いNMDA受容体のアロステリック作動薬であり,生体で分解されにくい非天然型アミノ酸と考えられていたことに着目し,統合失調症の新しい治療法開発を目的に,本症の動物モデルにこれらのD-アミノ酸および脂肪酸化合物を投与し,改善効果があることを明らかにした.この研究過程で投与したD-アミノ酸の脳における動態を調べ,D-セリンが定説に反して,脳優位に恒常的に哺乳類組織に高濃度に維持される内在性物質であることを初めて証明した8, 9).これらの結果から,脳のD-セリンがin vivoにおいてもNMDA受容体のコアゴニストとしての役割を果たし,その代謝・機能の研究が,統合失調症の病態解析や新規治療法開発に有用と考え,D-セリンシグナル制御の分子細胞機構の解析と統合失調症研究への応用の検討を進めている10).本稿では,これらの筆者らの研究をもとに,統合失調症を中心とした精神疾患におけるD-セリンシグナルの障害や治療のための調節法の可能性について概説する.
1)代謝
成熟期の哺乳類では,D-セリンの組織中濃度は脳で高く(200~300 nmol/g tissue),末梢臓器においては腎臓で低値の他は,肝臓,脾臓,下垂体,血液等で痕跡程度であり,脳優位に検出される9, 11).脳内においては,前脳部[大脳皮質,海馬,線条体,辺縁系前脳部(嗅結節,中隔,側坐核を含む)等]で高濃度,間脳(視床,視床下部)・中脳では中等度,橋・延髄・小脳等では低濃度であり,この不均一な分布は,NMDA受容体のグルタミン酸結合部位,グリシン結合部位,PCP結合部位(チャネル内)のいずれの各脳部位の密度とも強い正の相関を示す9).特にNMDA受容体GRIN2Bサブユニットの分布と酷似している9, 12, 13).これに対して齧歯類の出生時には,脳内分布はほぼ均一で,大脳皮質,小脳ともに生後7日までに濃度が上昇し,大脳皮質においては高濃度が維持されるが,小脳では生後21日までに急速に減少する11).こうした発達に伴う濃度変化も,GRIN2Bサブユニットの分布変化と同様である14).
脳において,L-セリンやグリシンの投与によりD-セリン濃度が増加し,D-セリンを投与するとL-セリンが増加するため,セリンラセマーゼ(SRR)の存在が示唆されたが15),実際に,哺乳類に特異的なセリンラセマーゼが単離・同定され16),同酵素遺伝子の欠損によりD-セリン濃度が10%程度に減少することも明らかになった17–19).L-セリン合成酵素遺伝子を脳選択的に欠損させると,血液を含む末梢組織のD-セリン濃度は変化しないが,脳のD-セリン濃度は10%程度まで低下した20).一方,組織中だけでなく細胞外液中にもD-セリンが存在し,各脳部位の濃度がNMDA受容体の密度と正の相関を示すことがわかった21).さらに,脳のホモジネートに飽和性のD-セリンの取り込み活性が認められた22).D-セリンを特異的に取り込むトランスポーターは検出されていないが,中性アミノ酸トランスポーターのAsc-123),ASCT124)およびASCT224, 25)にD-セリンの輸送能が認められている.古くからD-アミノ酸酸化酵素(DAO)の存在が知られていたが,D-セリンはDAOの基質となり,DAO活性欠損マウスでは脳のD-セリンが有意に増加することより,DAOは生理的なD-セリン分解酵素の一つと推測されている26).しかし,成熟期哺乳類の脳組織におけるDAO活性とD-セリン濃度の分布は逆相関し,たとえば,D-セリン濃度が最も高い大脳皮質ではDAO活性はほとんど検出されない.したがって,DAO以外にD-セリンの生理的分解系が存在する可能性も除外できない.
以上のように,脳内には,D-セリンの合成,貯蔵,細胞外放出,取り込み,および分解の過程があることが示唆されている(図1).各代謝過程で生理的に主要な役割を果たす分子は明らかでない部分が多いが,生合成にセリンラセマーゼが関与することは研究者間で一致して報告されている.
2)機能
a.D-セリンが作用する受容体
D-セリンは,GRIN1/GRIN2タイプ27)の他GRIN1/GRIN3タイプ28)のNMDA受容体や,δ2型グルタミン酸受容体(GRID2)29)にも作用することが報告されている.GRIN1/GRIN2タイプにおいては,D-セリンはコアゴニストとして機能しているが,その他のグルタミン酸受容体では作用様式が異なる.すなわち,GRIN1/GRIN3ヘテロメリックNMDA受容体では,グリシンは活性化するのに対し,D-セリンは抑制性,興奮性,あるいは部分的な興奮性等の異なる報告があり,さらに検討を要する.D-セリンのGRID2への親和性は,GRIN1/GRIN2タイプのNMDA受容体に比して低く29),同受容体は,成熟期にはD-セリン濃度がきわめて低い小脳に多く分布することから11),D-セリンの結合の生理的な意義については今後の研究が待たれる.最近,小脳に高濃度のD-セリンが含まれる発達期に,D-セリンによるGRID2の活性化が小脳の運動学習に関与することが報告され注目を集めている29).
b.細胞外液中D-セリン
以上のグルタミン酸受容体においては,直接結合すると推測される細胞外D-セリンが,活性調節に重要と考えられる.しかし,細胞外へD-セリンを放出する分子装置,主要な細胞とそのD-セリン貯蔵メカニズム等に対しては結論が得られていない.薬理学的な実験結果は,D-セリンが,シナプスで受容体に作用する点では類似している神経伝達物質とは,大きく異なる細胞外濃度調節機構を持つ可能性を示唆している.筆者らが,精神機能と関係が深い内側前頭葉皮質で,in vivoダイアリシスにより細胞外D-セリン濃度を検討したところ,(i)脱分極刺激後に著明に低下し,神経伝達物質のグルタミン酸,グリシンとは対照的な変化を示した.また,(ii)神経伝導遮断後には低下せずに軽度に上昇する,(iii)細胞外カルシウムイオン除去後も減少せずに軽度に増加する等の,神経伝達物質のドーパミンがそれぞれの操作でほとんど検出されなくなるのとは異なる反応が認められた21).さらに,D-セリンは,神経活動の上昇に対応した細胞外濃度の増加を示さないが,グリアの活動性を低下させると細胞外濃度が有意に減少するため30),シナプスでニューロンとグリアの双方の制御を受けると推察された.ヒトの死後脳大脳皮質では,ニューロンが豊富な灰白質とグリアが豊富な白質の双方でD-セリン濃度が高く,この仮説と矛盾しない.
これまでに筆者らは,内側前頭葉皮質の細胞外D-セリン濃度の調節に,(i)中性アミノ酸トランスポーターのAsc-123),(ii)カルシウム透過性AMPA型グルタミン酸受容体(phasicな抑制性制御)31),(iii)GABAA受容体(tonicな促進性制御)32),(iv)Dsm-1/PAPST1(D-セリンと類似した脳内分布を示しその取り込みと放出に影響する)33)等の分子が関与することを示唆する実験結果を得ている.GABAA受容体やAMPA受容体による細胞外D-セリン濃度の制御は,グリア細胞,ニューロンのいずれかの活動性を抑制するとみられなくなり31, 32),細胞外D-セリンシグナルの調節に双方の細胞系が関与していることが示唆された.一方,細胞外D-セリン濃度は,セリンラセマーゼ活性にも影響され,同遺伝子を欠損する動物の大脳皮質・海馬などで対照群の10%程度に減少することが報告されている34).セリンラセマーゼ様免疫反応がニューロンに認められ,D-セリンの組織中濃度は,セリンラセマーゼのニューロン特異的欠損マウスで減少し,アストログリア特異的欠損では有意な変化を示さないことより,細胞外D-セリンの調節にはニューロンのセリンラセマーゼが主な役割を果たすと考えられる35).
c.GRIN1/GRIN2型NMDA受容体の内在性コアゴニストとしてのD-セリン
D-セリンとNMDA受容体結合の密度の脳内分布が類似すること9),およびGRIN1/GRIN2型NMDA受容体遺伝子発現系の実験で,D-セリンが結合するグリシン調節部位が刺激されていないと,グルタミン酸による同受容体の十分な活性化が認められない点36)から,脳のD-セリンがGRIN1/GRIN2型NMDA受容体の内在性コアゴニストであることが予想された.
脳スライスで,DAOを作用させて,D-セリンを選択的に分解し,グリシンは変化しない条件を作り出すと,NMDA受容体のグルタミン酸結合部位の刺激への応答は著しく阻害され36),D-セリンが内在性コアゴニストであることが支持された.最近筆者らは,次のようにin vivoにおいても,D-セリンが内在性コアゴニストとして機能することを,in vivoダイアリシスを使って,NMDA誘発性の細胞外タウリン濃度の増加を指標としたNMDA受容体機能の検討を行うことにより明らかにした.(i)前脳部のニューロンのセリンラセマーゼ遺伝子を欠損するコンディショナルノックアウトマウスの海馬においては,細胞外のD-セリン濃度が減少するのに対してグリシン濃度は有意に変化せず,NMDA受容体機能が低下すること37)や,(ii)選択的GABAA受容体遮断薬を灌流したラットの内側前頭葉皮質においては,細胞外のグリシン濃度は変化せずにD-セリン濃度が減少し,NMDA受容体機能が阻害されること32)を示した.
NMDA受容体の機能低下によって,認知機能障害,統合失調症様症状,小脳失調症状等が生じ,過剰な刺激は神経細胞死,痛みの増強等が引き起こされることが,広く知られている10).したがって,NMDA受容体の障害は,認知症,統合失調症,脊髄小脳変性症,虚血性脳疾患,神経因性疼痛などの他,さまざまな精神神経疾患の病態に関与すると推察されている10).前項で述べたように,D-セリンは少なくとも前脳部においてGRIN1/GRIN2型NMDA受容体のコアゴニストとしての機能を担うことが明らかになり,精神神経疾患におけるNMDA受容体の病態の一部が,D-セリンの代謝・機能障害によるNMDA受容体へのD-セリンシグナルの変化に起因する可能性が検討されている.
1)統合失調症
統合失調症では,次のような臨床的な所見を根拠として,NMDA受容体の機能低下が病態に関与すると考えられている4, 10, 38, 39).(i)NMDA受容体遮断薬は例外なく統合失調症様の陽性症状,陰性症状ならびに認知機能障害を引き起こす,(ii)ケタミン(ketamine)ではNMDA受容体遮断作用が強い立体異性体S体の方が,その作用が弱い異性体R体よりも統合失調症様症状を惹起しやすい,(iii)抗NMDA受容体抗体も同症様の症状を発現させる,(iv)寛解期の統合失調症患者では,健常者には精神症状を引き起こさない少量のNMDA受容体遮断薬によって諸症状の再燃が生じ,NMDA受容体機能の低下が示唆される.
a.D-セリン代謝・機能の分子機構の変化(表1)
表1 統合失調症患者検体におけるD-セリンおよび代謝関連分子の変化 | 血液 | 脳脊髄液 | 死後脳 | | |
|---|
| | | 前頭前野 | 海馬 | 小脳 |
|---|
| D-セリン濃度 | ↓ → ↑ | ↓ → | →* | | |
| セリンラセマーゼ | ND | ND | ↓ ↑ ➡ | ↓ ↑ | → ➡ |
| D-アミノ酸酸化酵素 | ND | ND$ | ↑ ➡ | ↑# → | ↑ ➡ |
| Asc-1 | ND | ND | ↓ ➡ | ND | ↓ ➡ |
| DAOA/G72 | ↑ | → | ND | ND | |
*側頭葉・頭頂葉等でも変化は認められなかった.
$脈絡叢では免疫反応が上昇.
#罹病期間が20年を超える群.
説明は本文3節を参照.DAOA/G72:D-amino acid oxidase activator, 血液中・CSF中はタンパク質の発現.死後脳:↑型矢印はタンパク質の発現,➡型矢印はmRNAの発現.ND:未測定.本表は西川 徹(2014)D-セリンと統合失調症の病態および治療,アミノ酸研究,8巻2号,pp. 218–228の表1を一部改変した. |
NMDA受容体の機能不全につながる要因の一つとして,同受容体に結合する細胞外D-セリン濃度の低下が考えられる10).しかし,ヒト脳の細胞外D-セリンをin vivoで測定することは倫理的問題があり,死後脳では技術的に困難である.統合失調症死後脳大脳皮質の組織中D-セリン濃度には,これまで有意な変化は報告されていない40, 41).これに対して,D-セリンが作用するNMDA受容体グリシン結合部位の密度の増加が大脳皮質の種々の部位で観察されている42).また,D-セリンを分解するDAOの発現上昇が死後脳の脈絡叢(choroid plexus)43)や大脳皮質で見いだされ44),セリンラセマーゼタンパク質の発現減少が死後脳の大脳皮質・海馬で認められた41).NMDA受容体GRIN1, GRIN2およびGRIN3のサブユニットの変化も検出されている45).これらのD-セリン関連分子の所見は,研究者間での不一致もある.治療薬(抗精神病薬)の長期服用の影響も否定できないが,治療薬を長期投与した動物の脳では変化がみられないことをもとに,統合失調症の病態との関係を示唆している研究がある.
統合失調症死後脳大脳皮質においてグリシン結合部位の増加が認められたことは,細胞外D-セリン濃度が減少したための代償的変化の可能性がある.この推測と矛盾しないデータとして,未服薬の統合失調症患者の脳で,PETで計測した,NMDA受容体チャネル内のPCP結合部位へのリガンドの結合が低下する結果が得られている46).すなわち,同チャネルの開口頻度を増加させる細胞外D-セリンが減少したためとも考えられる.上記のD-セリン合成酵素の発現低下や分解酵素の発現上昇の結果としても説明可能である.
D-セリン濃度は血液や脳脊髄液でも測定されているが,結果は研究者間で一致せず,これまでのメタ解析(複数の独立した研究の結果を統合して統計学的に解析する手法)でも有意な変化は認められなかった47).前述したとおり,脳組織中のD-セリン濃度変化が体液中にまったく反映されない例があり,体液の物質は脳以外のさまざまな要因から影響を受けるため,特に血中D-セリン濃度の病態の指標として意義には疑問があり,今後の慎重な検証が待たれる.
b.D-セリン関連分子のゲノム解析
興味深いことに,統合失調症と関連が見いだされた13番染色体の13q34領域から新たに霊長類特異的遺伝子G72が同定され,DAOを活性化することが示唆された48).さらに,G72遺伝子と統合失調症との有意な相関を,複数の研究機関が一致して報告している49).以上の結果から,G72の過剰な発現がDAOの活性を増強し,D-セリンの分解が進んで細胞外D-セリンシグナルを減弱させる可能性が検討されている.統合失調症死後脳組織ではG72の有意な変化はないが増加傾向を認めた研究49)や,血液中のG72タンパク質の免疫反応性の上昇の報告50)がある.ただし,筆者らが最近血液中および脳脊髄液中で調べたところ,G72様免疫反応の有意な増加は再現されなかった51).
2014年には大規模サンプルを用いた,統合失調症–対照群の全ゲノム相関解析(GWAS)により,108の遺伝子と同症の有意な相関が発表され,D-セリンの病態の観点からは,SRRおよびNMDA受容体GRIN2Aサブユニットの遺伝子が含まれることが注目される52).しかし,GWAS相互,あるいはGWASと従前の候補遺伝子の相関解析との結果は不一致がみられることも多い.統合失調症は,遺伝学的に単一遺伝子疾患ではないと考えられることや,原因の異なる類似した症状を持つ疾患群からなるheterogeneityを持つと考えられ,こうしたゲノム解析研究間の不一致の基盤となっている可能性がある.
c.D-セリンシグナル低下動物と統合失調症
セリンラセマーゼ遺伝子を欠損するマウスでは,脳の組織中および細胞外液中のD-セリン濃度が野生型マウスの10%程度に減少するが,従来から報告されている,統合失調症に関連する行動学的,生化学的,形態学的な異常が出現し,D-セリンシグナルの低下がNMDA受容体機能不全を引き起こし統合失調症の病態に関与する可能性を支持している.
Coyleらの研究グループ17, 53)は,SRRのエクソン1を欠失させたノックアウトマウスを作出し,(i)長期増強誘導を指標としたNMDA受容体機能の低下,(ii)活動量増加,不安・驚愕反応の増大,(iii)海馬の樹状突起および体積の減少,(iv)海馬の形態学的変化(iii)と関連したBDNF/Akt/rapamycin(mTOR)シグナル系の減弱および(iv)認知機能障害(performance on a trace-conditioning memory taskの障害),等の異常を認めた.これらの変化はD-セリンの慢性投与により回復した.一方,Roderらの研究グループ18)は,N-nitroso-N-ethylureaが誘導した突然変異によってセリンラセマーゼ活性を失活したマウスにおいて,(i)統合失調症患者にみられるprepulse inhibitionの減弱(驚愕刺激の直前に微弱な驚愕刺激を与えると驚愕反応が減弱する現象;慣れを反映すると考えられ,ヒト・動物に共通して観察される),(ii)社会性行動や空間認知・記憶の障害,(iii)NMDA受容体遮断薬による活動性亢進およびprepulse inhibition減弱の誘発されやすさ(感受性亢進;より低用量で異常が生じる),等がみられ,(iv)行動障害はD-セリンまたは抗精神病薬のクロザピン(clozapine)の慢性投与によって改善することがわかった.
2)双極性障害
双極性障害においても,D-セリン関連分子の変化と病態の関係が検討されている.G72遺伝子については,統合失調症とは異なる一塩基多型(SNP)との有意な相関が,メタ解析で示されている54)が,死後脳の解析では有意な変化は見いだされていない44).筆者らは,D-セリンの放出・取り込みに影響するDSM-1/PAPST-1遺伝子のSNPが双極性障害と関連しており,死後脳前頭葉組織においてmRNAの発現が有意に増加していることを観察している(投稿中).
従来から,NMDA受容体機能障害が推測される精神神経疾患に対して,同受容体を調節する治療法の開発に,グルタミン酸結合部位,PCP結合部位,ポリアミン結合部位,亜鉛結合部位,グリシン結合部位等の多くの調節部位のうち,細胞傷害,細胞死,精神症状惹起作用等の有害作用がみられない,グリシン結合部位の作動薬または遮断薬が応用されてきた4, 10).機能促進を図る目的で,グリシン,D-サイクロセリン,D-セリン,D-アラニン等の作動薬はすでに臨床試験に用いられている4, 10, 55).内在性D-セリンの検出後は,DAO活性阻害による間接的な脳内D-セリン濃度の上昇を期待できる,サルコシン(sarcosine)や安息香酸ナトリウム(sodium benzoate)の臨床応用も行われている55).
1)統合失調症
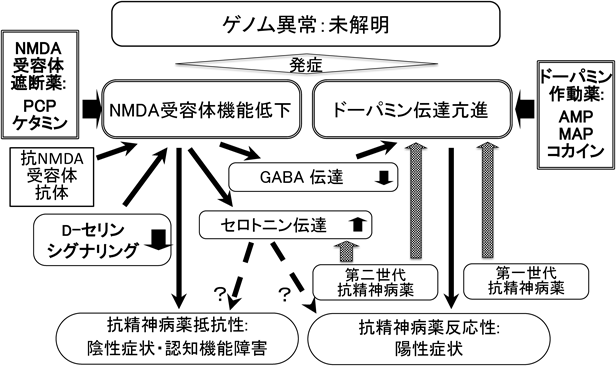
NMDA受容体の競合的・非競合的遮断薬や自己抗体が,統合失調症様の陽性症状,陰性症状および認知機能障害を引き起こすことから,統合失調症では同受容体の機能促進薬が全体の症状改善に役立つと考えられている.ドーパミン伝達遮断薬(主作用はD2型ドーパミン受容体遮断)である既存の抗精神病薬は,幻覚・妄想を中心とする陽性症状を改善するが,感情の平板化,会話・思考の貧困化,意欲減退,自閉等の陰性症状や,遂行機能,注意,ワーキングメモリー等の認知機能の障害にはほとんど効果を示さない4, 38).その結果,残存する症状が統合失調症の慢性化を招き,患者の完全な社会復帰を拒む主要因となっている4, 38).NMDA受容体遮断薬が主に大脳皮質でドーパミン伝達を著明に亢進させ56),その少なくとも一部はGABA伝達の抑制によることが明らかになった点57)を考え合わせると,統合失調症ではNMDA受容体の機能不全が,ドーパミン伝達の亢進を通じて陽性症状を引き起こし,ドーパミン以外のシステムの変化を介して陰性症状や認知機能障害が生じている機序が推察される(図2).近年臨床で使用されるようになった第二世代の抗精神病薬には強力なS2型セロトニン受容体遮断作用を持つものがあるが,同受容体の選択的な作動薬が一部の陽性症状を惹起する点58)からは,この作用も陰性症状,認知機能障害には効果がないと推測される.以上の研究結果より,NMDA受容体機能促進は,抗精神病薬反応性・抵抗性の双方の精神症状を改善することが期待されている.
a.NMDA受容体グリシン結合部位作動薬による抗精神病薬抵抗性症状の治療(図2)
前述した臨床的観察に基づいて,PCPをはじめとするNMDA受容体遮断薬を投与したマウスやラットに誘発される行動変化は,統合失調症の陽性・陰性症状と認知機能障害のモデルとみなされ,アンフェタミン類・コカインその他のドーパミン作動薬による動物の異常行動は陽性症状のモデルと考えられている.D2型ドーパミン受容体遮断薬の抗精神病薬が,前者を部分的に抑制し,後者を完全に改善することも,PCPあるいはメタンフェタミン(methamphetamine,覚醒剤)を乱用したヒトの精神症状に対する効果と一致している.筆者らの研究グループ5–7)とContreras59)は,PCPを投与した動物の行動変化を,脳室内に注入したグリシン結合部位の作動薬のD-セリンおよびD-アラニンが用量依存的に減弱させることを明らかにした.
これらの結果に基づき,グリシン結合部位の直接的・間接的な作動薬が,新規治療法開発の手がかりを得るために臨床応用された.すなわち,抗精神病薬を服用中で,陰性症状・認知機能障害が残存している患者にNMDA受容体グリシン結合部位の直接的な作動薬であるグリシンの他,選択性が高いD-サイクロセリン,D-セリン(表2の投与試験のまとめを参照),D-アラニン等,あるいは間接的作動薬の,DAO阻害作用を持つサルコシン・安息香酸ナトリウム,I型グリシントランスポーター阻害薬ビトペルチン(bitopertin)をadd on投与(併用投与)した60–62).いずれも,抗精神病薬抵抗性症状を改善したが著明な程度ではなく,統計学的に有意でない場合もあった.併用する抗精神病薬がクロザピンのときは,グリシン結合部位の作動薬による陰性症状・認知機能障害への効果はみられなかった.メタ解析においては,グリシン,D-セリン(表2)およびサルコシンは陰性症状への有意な改善効果が認められたが,D-サイクロセリンの効果はプラセボと有意差がなく,本剤が部分的作動薬でありNMDA受容体促進作用が不十分なためと推測された60, 61).認知機能障害のスコアの改善を認めた研究もあるが,メタ解析では有意なレベルには達していない60, 61).D-アラニン,安息香酸ナトリウム等は,これまでの試験では抗精神病薬抵抗性症状に効果的であったが,少数であるためメタ解析の結果は示されていない.ビトペルチンは,世界各地で大規模なランダム化比較試験(Randomized Control Trial:RCT)が実施されたが,一部の試験を除いて陰性症状や認知機能障害に対する効果は統計学的に有意ではなく,統合失調症治療薬としての開発は断念された.
表2 統合失調症患者または統合失調症高リスク群に対するD-セリンによる治療の臨床試験| D-セリンの用量 | 試験期間(週) | 症例数 | 方法(対照群) | 併用した抗精神病薬 | 陽性症状 | 陰性症状 | 認知機能障害 | 発表年 | 著者 |
|---|
| 30 mg/kg/day | 6 | 31 | 二重盲検比較試験(プラセボ) | 限定なし(クロザピンは除外) | 改善 | 改善 | 改善 | 1998 | Tsai et al.73) |
| 30 mg/kg/day | 6 | 20 | 二重盲検比較試験(プラセボ) | クロザピン | 不変 | 不変 | 不変 | 1999 | Tsai et al.74) |
| 30 mg/kg/day | 6 | 39 | 二重盲検クロスオーバー比較試験(プラセボ) | リスペリドン(risperidone)またはオランザピン | 改善 | 改善 | 改善 | 2005 | Heresco-Levy et al.75) |
| 2 g/day(サルコシンまたはD-セリン) | 6 | 44 | 二重盲検比較試験(プラセボ) | 限定なし(クロザピンは除外) | 改善 | 改善 | 改善 | 2005 | Lane et al.76) |
| 30, 60, 120 mg/kg/day | 4 | 42 | オープンラベル試験 | 限定なし(クロザピンは除外) | 改善 | 改善 | 改善(60 mg以上投与群) | 2010 | Kantrowitz et al.77) |
| 2 g/day | 6 | 40 | 二重盲検比較試験(プラセボ) | 限定なし(クロザピンは除外) | 不変 | 不変 | 不変 | 2010 | Lane et al.78) |
| 2 g/day | 16 | 195 | 二重盲検比較試験(プラセボ) | 限定なし(クロザピンは除外) | 不変 | 不変 | 不変 | 2012 | Weiser et al.79) |
| 1.5(1週)~3.0(9週)g/day | 10 | 5# | 二重盲検比較試験(オランザピン) | なし | 不変* | 改善* | 不変* | 2013 | Ermilov et al.80) |
| 60 mg/kg/day | 16 | 44¶ | 二重盲検比較試験(プラセボ) | なし | — | 改善 | — | 2015 | Kantrowitz et al.81) |
#Kaneら(1988)の定義による治療抵抗性統合失調症の入院患者18症例を対象とした試験を行いD-セリンを割りつけた10症例のうち,試験を完遂した5症例における評価.
¶統合失調症高リスク群(診断基準に合う症状はなく発症はしていないが遺伝学的にそのリスクが高い群).
*試験開始時点のスコアの比較でオランザピン(olanzapin)投与群との比較ではない. |
b.D-セリンの代謝・機能系を標的とした統合失調症治療薬の可能性
上述したように,統合失調症にNMDA受容体機能低下が関与することは,臨床薬理学的所見や同受容体自己抗体の作用から広く認められており,グリシン結合部位作動薬が症状を改善することからも支持される.しかし,効果が十分に強力でないことと安全性の点で,臨床応用可能なNMDA受容体機能を促進する治療薬の開発は難航している.直接グリシン結合部位を刺激するアミノ酸は,(i)血液脳関門の透過性が低く,高用量を必要とする上,(ii)D-セリンが腎臓に対する毒性を持つ,(iii)グリシンはNMDA受容体以外に抑制性グリシン受容体にも強力な作用を持ち,けいれん閾値を下げる等の問題があり,長期連用した場合の重篤な副作用が懸念される10, 55).
統合失調症で機能障害が生ずると推測される前脳部では,(i)細胞外のグリシン濃度が正常に維持されても,D-セリン濃度が減少するとNMDA受容体の機能が低下すること32, 36, 37)や,(ii)シナプスのNMDA受容体に作用するのはグリシンではなくD-セリンであると示唆されていること(グリシンはシナプス外のNMDA受容体に作用)63),および(iii)グリシンとD-セリンはグリシン結合部位への親和性や脳への移行性がほぼ同等であるが,臨床試験では統合失調症症状の改善を得るのにグリシンはD-セリンのおよそ30倍の用量を要していること61, 62)等より,シナプスの内在性D-セリン濃度を増加させる方法が,統合失調症におけるNMDA受容体機能を回復させる合理的な方法と考えられる.したがって,D-セリンの細胞外液中濃度に影響する分子を標的とした薬物が治療に有用な可能性がある.最近の神経生理学的研究で,認知機能の指標となる事象関連電位(外的・内的刺激に対する認知処理過程と関係する脳波成分)の統合失調症における異常が,グリシン作動薬のビトペルチンでは影響されず64),D-セリン投与(急性の単回または繰り返し投与)によって改善されることが確認された点65, 66)は,同症の治療におけるD-セリンシグナルの重要性を示唆している.
この観点からDAO阻害薬は候補の一つとなる.しかし,哺乳類ではDAOの脳内分布はD-セリンと逆相関しており,DAO活性欠損動物の前脳部のD-セリン濃度の増加率は小さく,有意な変化がみられない場合も報告されている.そこで,筆者らは別の視点から,D-セリンシグナル操作によるNMDA受容体機能の促進を図る方法を検討している.統合失調症では,NMDA受容体の機能低下の代償的変化として,シナプスにおけるグルタミン酸の放出が増加し,グルタミン酸のAMPA型受容体やカイニン酸型受容体が過剰に刺激されると推測されている67).この仮説を支持する所見として,PCPを投与した動物脳では,細胞外グルタミン酸濃度が上昇する現象がみられる67).筆者らは,カルシウム透過性AMPA受容体の遮断薬が,同受容体の過剰な刺激による細胞外D-セリン濃度の低下を完全に阻害した実験結果に着目し(2.2)-a項参照31)),同受容体遮断薬の統合失調症の動物モデルに対する影響を観察した68).
これらの実験から,カルシウム透過性AMPA受容体の選択的遮断薬であるIEM1460を皮下投与したマウスでは,基礎的な活動性に変化を引き起こさないが,PCP, MK801(dizocilpine)等のNMDA受容体遮断薬投与時の活動性の増加を有意に抑制することことを初めて見いだした68).また,陽性症状のモデルであるメタンフェタミンを投与したマウスの活動亢進も減弱させた68).以上の結果は,カルシウム透過性AMPA受容体遮断が,統合失調症において脳の細胞外D-セリン濃度の減少を回復することにより抗精神病薬反応性・抵抗性双方の症状を改善する可能性を示唆している68).臨床的な効果を予測するため,今後さらに,活動性亢進だけでなく,動物における統合失調症モデルの異常行動に対する効果の詳細な検討が必要と考えられる.
この他,細胞外D-セリン濃度を制御するGABAA受容体,中性アミノ酸トランスポーターのAsc-1, ASCT1およびASCT2等もD-セリンシグナル増強薬開発の標的として期待できる.
2)不安障害
強迫性障害(obsessive-compulsive disorder:OCD),恐怖症,心的外傷後ストレス障害(post traumatic stress disorder:PTSD),社会不安障害等において,以下に述べる記憶・学習のメカニズムの知見に基づき,認知行動療法を強化する薬物療法として,NMDA受容体機能を増強するグリシン結合部位の作動薬が導入されている69).
すなわち,これらの病態には,特定の刺激や状況が不安・恐怖等の不快な情動反応につながる,恐怖条件づけに類似した記憶・学習の機序が基盤にあると推察されている.特定の刺激に続いて不快刺激を与え,恐怖条件づけが成立した後に,不快刺激を伴わない同じ刺激を繰り返し経験していると,両者の結びつきが次第に減弱し(不快刺激と関係していないことを学習する),特定の刺激を受けても不快反応が生じなくなる.これを消去(extinction)と呼び,認知行動療法として,さまざまな不安障害の治療に応用されている.消去は記憶・学習過程の一つで,動物実験においてNMDA受容体機能増強が重要な役割を果たすことが確立されていることから70),認知行動療法の強化を目的として,NMDA受容体機能を促進する用量のD-サイクロセリンを併用する効果が検討されている.D-サイクロセリンが,認知行動療法による症状改善までの時間を短縮することや,改善度を増大させる効果が報告されている69)が,有意な効果が認められない二重盲検試験の結果もあり,NMDA受容体機能を増強する薬物の開発・選択が今後の課題と考えられる.その一環として,細胞外D-セリン濃度を効率的に上昇させる,GABAA受容体,中性アミノ酸トランスポーター,セリンラセマーゼ,DAO等への新規作用薬の創出が期待される.
3)うつ病
NMDA受容体遮断作用を持つケタミンが即効性の抗うつ効果を持つことが発見されて以来,うつ病とNMDA受容体機能亢進との関連が注目されている71).この可能性は,それ以前から抗うつ薬の中に軽度から中等度のNMDA受容体遮断作用を持つ薬物があることに基づいて検討され,動物実験ではGRIN2Bサブユニット選択的遮断薬がうつ病モデルを改善することが報告されている72).臨床的には,グリシン結合部位に対する遮断効果を期待して,部分作動薬のD-サイクロセリンの高用量をうつ病患者に投与したところ,改善がみられたという69).少数の試験しか行われていないため,さらに多くの症例での検証が待たれる.したがって,グリシン結合部位へのD-セリンシグナルを減弱させる薬物が抗うつ薬として役立つ可能性があり,筆者らの研究より,カルシウム透過性AMPA受容体の作動薬が候補となりうると考えられる.
本稿で紹介したように,脳のD-セリンはシナプスでGRIN1/GRIN2型NMDA受容体,GRIN1/GRIN3型NMDA受容体およびGRID2等に作用し,広く高次脳機能の発現・調節とその病態に関与することが明らかにされてきた.少なくとも前脳部GRIN1/GRIN2型NMDA受容体の生理的活性化に不可欠なコアゴニストであり,その細胞外濃度の調節は神経伝達物質とはまったく異なり,神経活動と連動した急速な増加と消去ではなく,一定に維持されることが重要と推測される.ニューロンだけでなくグリアの活動と密接に関連した脳内分布と動態を示すことも,このような機能の特徴と関係があると考えられる.一方,これまでの基礎的・臨床的研究から,D-セリンシグナルの制御の障害が統合失調症をはじめとする種々の精神疾患と関係しており,その修復が,既存の薬物では改善が困難であった症状の革新的な治療につながることが示唆されている.したがって,不明の部分が多いD-セリンシグナル制御の分子細胞機構を解明することによって,ニューロンとグリアを統合する未知の脳のシステムにアプローチする道が拓かれ,精神疾患の病態の理解や新規治療法の開発が大きく促進されることが期待される.
引用文献References
1) Danysz, W. & Parsons, C.G. (1998) Glycine and N-methyl-D-aspartate receptors: physiological significance and possible therapeutic applications. Pharmacol. Rev., 50, 597–664.
2) Petersen, R.C. & Stillman, R.C. eds. (1978) Phencyclidine (PCP) Abuse: An Appraisal. National Institute on Drug Abuse Research Monographs, Superintendent of Documents, pp. 313, U.S. Government Printing Office, Washington D.C.
3) Anis, N.A., Berry, S.C., Burton, N.R., & Lodge, D. (1983) The dissociative anaesthetics, ketamine and phencyclidine, selectively reduce excitation of central mammalian neurones by N-methyl-aspartate. Br. J. Pharmacol., 79, 565–575.
4) 西川 徹(1990)精神分裂病の新しい治療薬の可能性,精神科治療学,5, 187–202.
5) 谷井靖之,西川 徹,日比野英彦,高橋清久(1991)Phencyclidineによって出現する異常行動とN-methy-D-aspartate受容体アロステリック調節部位との関連性について,脳と精神の医学,2, 497–502.
6) Tanii, Y., Nishikawa, T., Hashimoto, A., & Takahashi, K. (1991) Stereoselective inhibition by D- and L-alanine of phencyclidineinduced locomotor stimulation in the rat. Brain Res., 563, 281–284.
7) Tanii, Y., Nishikawa, T., Hashimoto, A., & Takahashi, K. (1994) Stereoselective antagonism by enantiomers of alanine and serine of phencyclidine-induced hyperactiviy, stereotypy and ataxia in the rat. J. Pharmacol. Exp. Ther., 269, 1040–1048.
8) Hashimoto, A., Nishikawa, T., Hayashi, T., Fujii, N., Harada, K., Oka, T., & Takahashi, K. (1992) The presence of free D-serine in rat brain. FEBS Lett., 296, 33–36.
9) Hashimoto, A., Nishikawa, T., Oka, T., & Takahashi, K. (1993) Endogenous D-serine in rat brain: N-Methyl-D-aspartate receptor-related distribution and aging. J. Neurochem., 60, 783–786.
10) Nishikawa, T. (2011) Analysis of free D-serine in mammals and its biological relevance. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci., 879, 3169–3183.
11) Hashimoto, A., Oka, T., & Nishikawa, T. (1995) Anatomical distribution and postnatal changes in endogenous free D-aspartate and D-serine in rat brain and periphery. Eur. J. Neurosci., 7, 1657–1663.
12) Nishikawa, T., Hashimoto, A., Tanii, Y., Umino, A., Kashiwa, A., Kumashiro, S., Nishijima, K., Oka, T., Shirayama, Y., & Takahashi, K. (1994) Disturbed neurotransmission via the N-methyl-D-aspartate receptor and schizophrenia, in The Biology of Schizophrenia (Moroji, T. & Yamamoto, K. eds.), Development of Psychiatry Series, pp. 197–207, Elsevier, Amsterdam.
13) Nakanishi, S. (1992) Molecular diversity of glutamate receptors and implications for brain function. Science, 258, 597–603.
14) Watanabe, M., Inoue, Y., Sakimura, K., & Mishina, M. (1992) Developmental changes in distribution of NMDA receptor channel subunit mRNAs. Neuroreport, 3, 1138–1140.
15) Takahashi, K., Hayashi, F., & Nishikawa, T. (1997) In vivo evidence for the link between L- and D-serine metabolism in rat cerebral cortex. J. Neurochem., 69, 1286–1290.
16) Wolosker, H., Sheth, K.N., Takahashi, M., Mothet, J.P., Brady, R.O. Jr., Ferris, C.D., & Snyder, S.H. (1999) Purification of serine racemase: biosynthesis of the neuromodulator D-serine. Proc. Natl. Acad. Sci. USA, 96, 721–725.
17) Basu, A.C., Tsai, G.E., Ma, C.L., Ehmsen, J.T., Mustafa, A.K., Han, L., Jiang, Z.I., Benneyworth, M.A., Froimowitz, M.P., Lange, N., et al. (2009) Targeted disruption of serine racemase affects glutamatergic neurotransmission and behavior. Mol. Psychiatry, 14, 719–727.
18) Labrie, V., Fukumura, R., Rastogi, A., Fick, L.J., Wang, W., Boutros, P.C., Kennedy, J.L., Semeralul, M.O., Lee, F.H., Baker, G.B., et al. (2009) Serine racemase is associated with schizophrenia susceptibility in humans and in a mouse model. Hum. Mol. Genet., 18, 3227–3243.
19) Inoue, R., Hashimoto, K., Harai, T., & Mori, H. (2008) NMDA- and beta-amyloid1-42-induced neurotoxicity is attenuated in serine racemase knock-out mice. J. Neurosci., 28, 14486–14491.
20) Yang, J.H., Wada, A., Yoshida, K., Miyoshi, Y., Sayano, T., Esaki, K., Kinoshita, M.O., Tomonaga, S., Azuma, N., Watanabe, M., et al. (2010) Brain-specific Phgdh deletion reveals a pivotal role for L-serine biosynthesis in controlling the level of D-serine, an N-methyl-D-aspartate receptor co-agonist, in adult brain. J. Biol. Chem., 285, 41380–41390.
21) Hashimoto, A., Oka, T., & Nishikawa, T. (1995) Extracellular concentration of endogenous free D-serine in the rat brain as revealed by in vivo microdialysis. Neuroscience, 66, 635–643.
22) Yamamoto, N., Tomita, U., Umino, A., & Nishikawa, T. (2001) Uptake of D-serine by synaptosomal P2 fraction isolated from rat brain. Synapse, 42, 84–86.
23) Ishiwata, S., Ogata, S., Umino, A., Shiraku, H., Ohashi, Y., Kajii, Y., & Nishikawa, T. (2013) Increasing effects of S-methyl-L-cysteine on the extracellular D-serine concentrations in the rat medial frontal cortex. Amino Acids, 44, 1391–1395.
24) Kaplan, E., Zubedat, S., Radzishevsky, I., Valenta, A.C., Rechnitz, O., Sason, H., Sajrawi, C., Bodner, O., Konno, K., Esaki, K., et al. (2018) ASCT1 (Slc1a4) transporter is a physiologic regulator of brain d-serine and neurodevelopment. Proc. Natl. Acad. Sci. USA, 115, 9628–9633.
25) Hayashi, F., Takahashi, K., & Nishikawa, T. (1997) Uptake of D- and L-serine in C6 glioma cells. Neurosci. Lett., 239, 85–88.
26) Hashimoto, A., Nishikawa, T., Konno, R., Niwa, A., Yasumura, Y., Oka, T., & Takahashi, K. (1993) Free D-serine, D-aspartate and D-alanine in central nervous system and serum in mutant mice lacking D-amino acid oxidase. Neurosci. Lett., 152, 33–36.
27) Matsui, T., Sekiguchi, M., Hashimoto, A., Tomita, U., Nishikawa, T., & Wada, K. (1995) Functional comparison of D-serine and glycine in rodents: the effect on cloned NMDA receptors and the extracellular concentration. J. Neurochem., 65, 454–458.
28) Chatterton, J.E., Awobuluyi, M., Premkumar, L.S., Takahashi, H., Talantova, M., Shin, Y., Cui, J., Tu, S., Sevarino, K.A., Nakanishi, N., et al. (2002) Excitatory glycine receptors containing the NR3 family of NMDA receptor subunits. Nature, 415, 793–798.
29) Kakegawa, W., Miyoshi, Y., Hamase, K., Matsuda, S., Matsuda, K., Kohda, K., Emi, K., Motohashi, J., Konno, R., Zaitsu, K., et al. (2011) D-serine regulates cerebellar LTD and motor coordination through the δ2 glutamate receptor. Nat. Neurosci., 14, 603–611.
30) Kanematsu, S., Ishii, S., Umino, A., Fujihira, T., Kashiwa, A., Yamamoto, N., Kurumaji, A., & Nishikawa, T. (2006) Evidence for involvement of glial cell activity in the control of extracellular D-serine contents in the rat brain. J. Neural Transm. (Vienna), 113, 1717–1721.
31) Ishiwata, S., Umino, A., Umino, M., Yorita, K., Fukui, K., & Nishikawa, T. (2013) Modulation of extracellular d-serine content by calcium permeable AMPA receptors in rat medial prefrontal cortex as revealed by in vivo microdialysis. Int. J. Neuropsychopharmacol., 16, 1395–1406.
32) Umino, A., Ishiwata, S., Iwama, H., & Nishikawa, T. (2017) Evidence for Tonic Control by the GABA(A) Receptor of extracellular D-serine concentrations in the medial prefrontal cortex of rodents. Front. Mol. Neurosci., 10, 240.
33) Shimazu, D., Yamamoto, N., Umino, A., Ishii, S., Sakurai, S., & Nishikawa, T. (2006) Inhibition of D-serine accumulation in the Xenopus oocyte by expression of the rat ortholog of human 3′-phosphoadenosine 5′-phosphosulfate transporter gene isolated from the neocortex as D-serine modulator-1. J. Neurochem., 96, 30–42.
34) Miyoshi, Y., Konno, R., Sasabe, J., Ueno, K., Tojo, Y., Mita, M., Aiso, S., & Hamase, K. (2012) Alteration of intrinsic amounts of D-serine in the mice lacking serine racemase and D-amino acid oxidase. Amino Acids, 43, 1919–1931.
35) Balu, D.T., Takagi, S., Puhl, M.D., Benneyworth, M.A., & Coyle, J.T. (2014) D-serine and serine racemase are localized to neurons in the adult mouse and human forebrain. Cell. Mol. Neurobiol., 34, 419–435.
36) Mothet, J.P., Parent, A.T., Wolosker, H., Brady, R.O. Jr., Linden, D.J., Ferris, C.D., Rogawski, M.A., & Snyder, S.H. (2000) D-serine is an endogenous ligand for the glycine site of the N-methyl-D-aspartate receptor. Proc. Natl. Acad. Sci. USA, 97, 4926–4931.
37) Ishiwata, S., Umino, A., Balu, D.T., Coyle, J.T., & Nishikawa, T. (2015) Neuronal serine racemase regulates extracellular D-serine levels in the adult mouse hippocampus. J. Neural Transm. (Vienna), 122, 1099–1103.
38) 西川 徹,岩間久行(1992)興奮性アミノ酸受容体と新しい抗精神病薬,精神分裂病はどこまでわかったか(町山幸輝,樋口輝彦編),pp. 123–157, 星和書店(東京).
39) Kayser, M.S. & Dalmau, J. (2016) Anti-NMDA receptor encephalitis, autoimmunity, and psychosis. Schizophr. Res., 176, 36–40.
40) Kumashiro, S., Hashimoto, A., & Nishikawa, T. (1995) Free D-serine in post-mortem brains and spinal cords of individuals with and without neuropsychiatric diseases. Brain Res., 681, 117–125.
41) Bendikov, I., Nadri, C., Amar, S., Panizzutti, R., De Miranda, J., Wolosker, H., & Agam, G. (2007) A CSF and postmortem brain study of D-serine metabolic parameters in schizophrenia. Schizophr. Res., 90, 41–51.
42) Ishimaru, M., Kurumaji, A., & Toru, M. (1994) Increases in strychnine-insensitive glycine binding sites in cerebral cortex of chronic schizophrenics: evidence for glutamate hypothesis. Biol. Psychiatry, 35, 84–95.
43) Ono, K., Shishido, Y., Park, H.K., Kawazoe, T., Iwana, S., Chung, S.P., Abou El-Magd, R.M., Yorita, K., Okano, M., Watanabe, T., et al. (2009) Potential pathophysiological role of D-amino acid oxidase in schizophrenia: immunohistochemical and in situ hybridization study of the expression in human and rat brain. J. Neural Transm. (Vienna), 116, 1335–1347.
44) Madeira, C., Freitas, M.E., Vargas-Lopes, C., Wolosker, H., & Panizzutti, R. (2008) Increased brain D-amino acid oxidase (DAAO) activity in schizophrenia. Schizophr. Res., 101, 76–83.
45) Catts, V.S., Lai, Y.L., Weickert, C.S., Weickert, T.W., & Catts, S.V. (2016) A quantitative review of the postmortem evidence for decreased cortical N-methyl-D-aspartate receptor expression levels in schizophrenia: How can we link molecular abnormalities to mismatch negativity deficits? Biol. Psychol., 116, 57–67.
46) Pilowsky, L.S., Bressan, R.A., Stone, J.M., Erlandsson, K., Mulligan, R.S., Krystal, J.H., & Ell, P.J. (2006) First in vivo evidence of an NMDA receptor deficit in medication-free schizophrenic patients. Mol. Psychiatry, 11, 118–119.
47) Brouwer, A., Luykx, J.J., van Boxmeer, L., Bakker, S.C., & Kahn, R.S. (2013) NMDA-receptor coagonists in serum, plasma, and cerebrospinal fluid of schizophrenia patients: a meta-analysis of case-control studies. Neurosci. Biobehav. Rev., 37, 1587–1596.
48) Chumakov, I., Blumenfeld, M., Guerassimenko, O., Cavarec, L., Palicio, M., Abderrahim, H., Bougueleret, L., Barry, C., Tanaka, H., La Rosa, P., et al. (2002) Genetic and physiological data implicating the new human gene G72 and the gene for D-amino acid oxidase in schizophrenia. Proc. Natl. Acad. Sci. USA, 99, 13675–13680.
49) Coyle, J.T., Basu, A., Benneyworth, M., Balu, D., & Konopaske, G. (2012) Glutamatergic synaptic dysregulation in schizophrenia: therapeutic implications. Handb. Exp. Pharmacol., 213, 267–295.
50) Lin, C.H., Chang, H.T., Chen, Y.J., Lin, C.H., Huang, C.H., Tun, R., Tsai, G.E., & Lane, H.Y. (2014) Distinctively higher plasma G72 protein levels in patients with schizophrenia than in healthy individuals. Mol. Psychiatry, 19, 636–637.
51) Ishiwata, S., Hattori, K., Sasayama, D., Teraishi, T., Miyakawa, T., Yokota, Y., Matsumura, R., Yoshida, F., Nishikawa, T., & Kunugi, H. (2017) Plasma and cerebrospinal fluid G72 protein levels in schizophrenia and major depressive disorder. Psychiatry Res., 254, 244–250.
52) Schizophrenia Working Group of the Psychiatric Genomics Consortium. (2014) Biological insights from 108 schizophrenia-associated genetic loci. Nature, 511, 421–427.
53) Balu, D.T., Li, Y., Puhl, M.D., Benneyworth, M.A., Basu, A.C., Takagi, S., Bolshakov, V.Y., & Coyle, J.T. (2013) Multiple risk pathways for schizophrenia converge in serine racemase knockout mice, a mouse model of NMDA receptor hypofunction. Proc. Natl. Acad. Sci. USA, 110, E2400–E2409.
54) Müller, D.J., Zai, C.C., Shinkai, T., Strauss, J., & Kennedy, J.L. (2011) Association between the DAOA/G72 gene and bipolar disorder and meta-analyses in bipolar disorder and schizophrenia. Bipolar Disord., 13, 198–207.
55) Nishikawa, T. (2016) D-Serine signaling and schizophrenia, in D-Amino Acids—Physiology, Metabolism, and Application—(Yoshimura, T., Nishikawa, T., & Homma, H. eds.), pp. 81–100, Springer, Tokyo.
56) Umino, A., Takahashi, K., & Nishikawa, T. (1998) Characterization of phencyclidine-induced increase in prefrontal cortical dopmaine metabolism in the rat. Br. J. Pharmacol., 124, 377–385.
57) Yonezawa, Y., Kuroki, T., Kawahara, T., Tashiro, N., & Uchimura, H. (1998) Involvement of gamma-aminobutyric acid neurotransmission in phencyclidine-induced dopamine release in the medial prefrontal cortex. Eur. J. Pharmacol., 341, 45–56.
58) Gouzoulis-Mayfrank, E., Heekeren, K., Neukirch, A., Stoll, M., Stock, C., Obradovic, M., & Kovar, K.A. (2005) Psychological effects of (S)-ketamine and N,N-dimethyltryptamine (DMT): a double-blind, cross-over study in healthy volunteers. Pharmacopsychiatry, 38, 301–311.
59) Contreras, P.C. (1990) D-serine antagonized phencyclidine- and MK-801-induced stereotyped behavior and ataxia. Neuropharmacology, 29, 291–293.
60) Tsai, G.E. & Lin, P.Y. (2010) Strategies to enhance N-methyl-D-aspartate receptor-mediated neurotransmission in schizophrenia, a critical review and meta-analysis. Curr. Pharm. Des., 16, 522–537.
61) Singh, S.P. & Singh, V. (2011) Meta-analysis of the efficacy of adjunctive NMDA receptor modulators in chronic schizophrenia. CNS Drugs, 25, 859–885.
62) Umbricht, D., Alberati, D., Martin-Facklam, M., Borroni, E., Youssef, E.A., Ostland, M., Wallace, T.L., Knoflach, F., Dorflinger, E., Wettstein, J.G., et al. (2014) Effect of bitopertin, a glycine reuptake inhibitor, on negative symptoms of schizophrenia: a randomized, double-blind, proof-of-concept study. JAMA Psychiatry, 71, 637–646.
63) Papouin, T., Ladépêche, L., Ruel, J., Sacchi, S., Labasque, M., Hanini, M., Groc, L., Pollegioni, L., Mothet, J.P., & Oliet, S.H. (2012) Synaptic and extrasynaptic NMDA receptors are gated by different endogenous coagonists. Cell, 150, 633–646.
64) Kantrowitz, J.T., Nolan, K.A., Epstein, M.L., Lehrfeld, N., Shope, C., Petkova, E., & Javitt, D.C. (2017) Neurophysiological effects of bitopertin in schizophrenia. J. Clin. Psychopharmacol., 37, 447–451.
65) Kantrowitz, J.T., Epstein, M.L., Beggel, O., Rohrig, S., Lehrfeld, J.M., Revheim, N., Lehrfeld, N.P., Reep, J., Parker, E., Silipo, G., et al. (2016) Neurophysiological mechanisms of cortical plasticity impairments in schizophrenia and modulation by the NMDA receptor agonist D-serine. Brain, 139, 3281–3295.
66) Kantrowitz, J.T., Epstein, M.L., Lee, M., Lehrfeld, N., Nolan, K.A., Shope, C., Petkova, E., Silipo, G., & Javitt, D.C. (2018) Improvement in mismatch negativity generation duringd-serine treatment in schizophrenia: Correlation with symptoms. Schizophr. Res., 191, 70–79.
67) Moghaddam, B. & Adams, B.W. (1998) Reversal of phencyclidine effects by a group II metabotropic glutamate receptor agonist in rats. Science, 281, 1349–1352.
68) Umino, M., Umino, A., & Nishikawa, T. (2018) Effects of selective calcium-permeable AMPA receptor blockade by IEM 1460 on psychotomimetic-induced hyperactivity in the mouse. J. Neural Transm. (Vienna), 125, 705–711.
69) Schade, S. & Paulus, W. (2016) D-cycloserine in neuropsychiatric diseases: A systematic review. Int. J. Neuropsychopharmacol., 19, 1–7.
70) Davis, M. (2011) NMDA receptors and fear extinction: implications for cognitivebehavioral therapy. Dialogues Clin. Neurosci., 13, 463–474.
71) Abdallah, C.G., Sanacora, G., Duman, R.S., & Krystal, J.H. (2018) The neurobiology of depression, ketamine and rapid-acting antidepressants: Is it glutamate inhibition or activation? Pharmacol. Ther., 190, 148–158.
72) Zhang, L., Xu, T., Wang, S., Yu, L., Liu, D., Zhan, R., & Yu, S.Y. (2013) NMDA GluN2B receptors involved in the antidepressant effects of curcumin in the forced swim test. Prog. Neuropsychopharmacol. Biol. Psychiatry, 40, 12–17.
73) Tsai, G., Yang, P., Chung, L.C., Lange, N., & Coyle, J.T. (1998) D-serine added to antipsychotics for the treatment of schizophrenia. Biol. Psychiatry, 44, 1081–1089.
74) Tsai, G.E., Yang, P., Chung, L.C., Tsai, I.C., Tsai, C.W., & Coyle, J.T. (1999) D-serine added to clozapine for the treatment of schizophrenia. Am. J. Psychiatry, 156, 1822–1825.
75) Heresco-Levy, U., Javitt, D.C., Ebstein, R., Vass, A., Lichtenberg, P., Bar, G., Catinari, S., & Ermilov, M. (2005) D-serine efficacy as add-on pharmacotherapy to risperidone and olanzapine for treatment-refractory schizophrenia. Biol. Psychiatry, 57, 577–585.
76) Lane, H.Y., Chang, Y.C., Liu, Y.C., Chiu, C.C., & Tsai, G.E. (2005) Sarcosine or D-serine add-on treatment for acute exacerbation of schizophrenia, a randomized, double-blind, placebo-controlled study. Arch. Gen. Psychiatry, 62, 1196–1204.
77) Kantrowitz, J.T., Malhotra, A.K., Cornblatt, B., Silipo, G., Balla, A., Suckow, R.F., D’Souza, C., Saksa, J., Woods, S.W., & Javitt, D.C. (2010) High dose D-serine in the treatment of schizophrenia. Schizophr. Res., 121, 125–130.
78) Lane, H.Y., Lin, C.H., Huang, Y.J., Liao, C.H., Chang, Y.C., & Tsai, G.E. (2010) A randomized, double-blind, placebo-controlled comparison study of sarcosine (N-methylglycine) and D-serine add-on treatment for schizophrenia. Int. J. Neuropsychopharmacol., 13, 451–460.
79) Weiser, M., Heresco-Levy, U., Davidson, M., Javitt, D.C., Werbeloff, N., Gershon, A.A., Abramovich, Y., Amital, D., Doron, A., Konas, S., et al. (2012) A multicenter, add-on randomized controlled trial of low-dose d-serine for negative and cognitive symptoms of schizophrenia. J. Clin. Psychiatry, 73, e728–e734.
80) Ermilov, M., Gelfin, E., Levin, R., Lichtenberg, P., Hashimoto, K., Javitt, D.C., & Heresco-Levy, U. (2013) A pilot double-blind comparison of d-serine and high-dose olanzapine in treatment-resistant patients with schizophrenia. Schizophr. Res., 150, 604–605.
81) Kantrowitz, J.T., Woods, S.W., Petkova, E., Cornblatt, B., Corcoran, C.M., Chen, H., Silipo, G., & Javitt, D.C. (2015) D-serine for the treatment of negative symptoms in individuals at clinical high risk of schizophrenia, a pilot, double-blind, placebo-controlled, randomised parallel group mechanistic proof-of-concept trial. Lancet Psychiatry, 2, 403–412.
著者紹介Author Profile
 西川 徹(にしかわ とおる)
西川 徹(にしかわ とおる)昭和大学医学部薬理学講座医科薬理学部門・薬理科学研究センター客員教授.医学博士.
略歴1977年東京医科歯科大学医学部卒業.1994年国立精神・神経医療研究センター神経研究所疾病研究第三部部長,1999年東京医科歯科大学精神行動医科学分野教授,2018年同名誉教授,現職.
研究テーマと抱負(1)統合失調症の病因,発症,病態の分子細胞機構解明と新規治療法開発に関する研究,(2)脳におけるD-セリンの代謝・機能・病態の分子細胞生物学的研究.