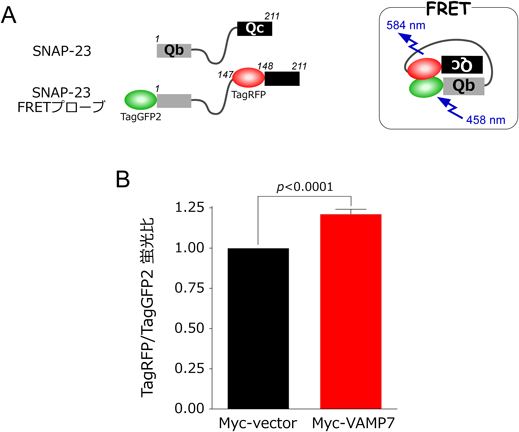
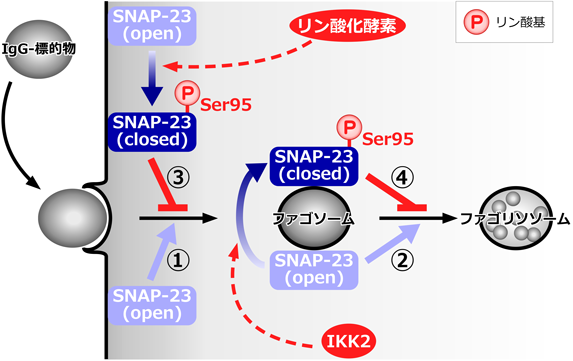
ファゴサイトーシスにおけるSNAP-23の役割と制御機構Role of SNAP-23 in phagocytosis and its regulatory mechanism
国立大学法人鳥取大学医学部生命科学科Division of Molecular Biology, School of Life Sciences, Faculty of Medicine, Tottori University ◇ 〒683–8503 鳥取県米子市西町86 ◇ 86 Nishi-cho, Yonago, Tottori 683–8503, Japan