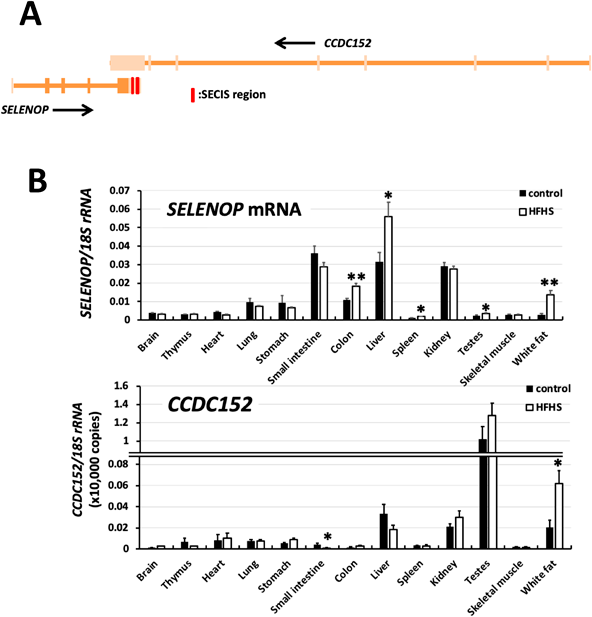
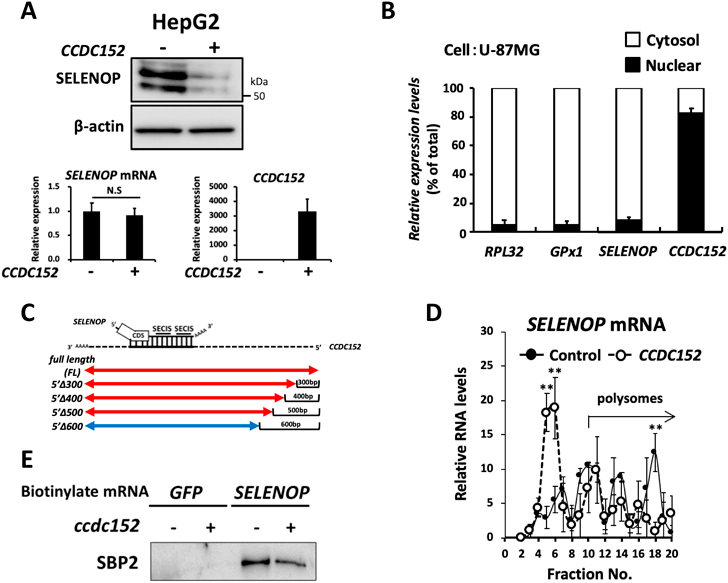
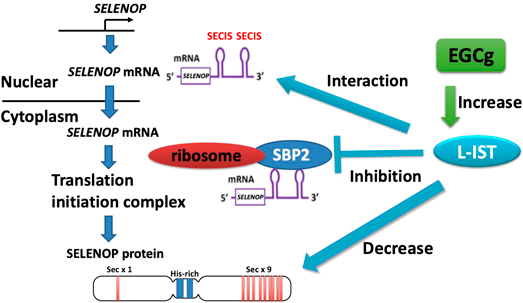
セレノプロテインPの翻訳を抑制する新規noncoding RNAの同定およびその病態生理学的意義Identification of novel noncoding RNA that suppress translation of selenoprotein P and its pathophysiological implication
1 同志社大学生命医科学部医生命システム学科システム生命科学研究室The Systems Life Sciences laboratory, Department of Medical Life Systems, Faculty of Life and Medical Sciences, Doshisha University ◇ 〒610–0394 京都府京田辺市多々羅都谷1–3 ◇ 1–3 Miyakodani, Tatara, Kyotanabe, Kyoto 610–0394, Japan
2 東北大学大学院薬学研究科代謝制御薬学分野Laboratory of Molecular Biology and Metabolism, Graduate School of Pharmaceutical Sciences, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区荒巻字青葉6–3 C301 ◇ C301, 6–3 Aoba, Aramaki, Aoba-ku, Sendai, Miyagi 980–8578, Japan