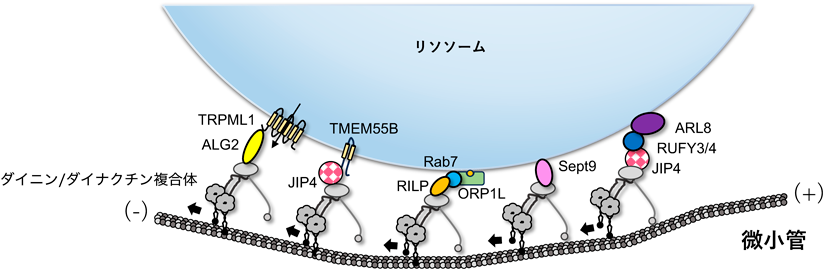
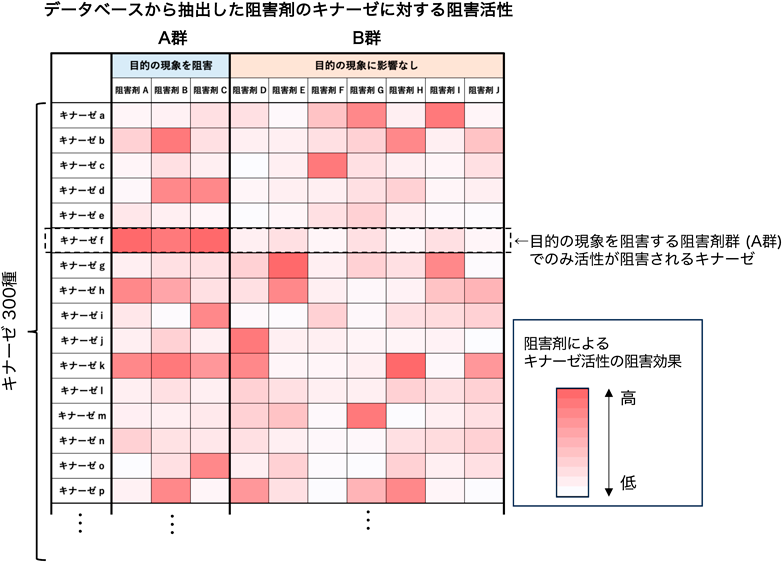
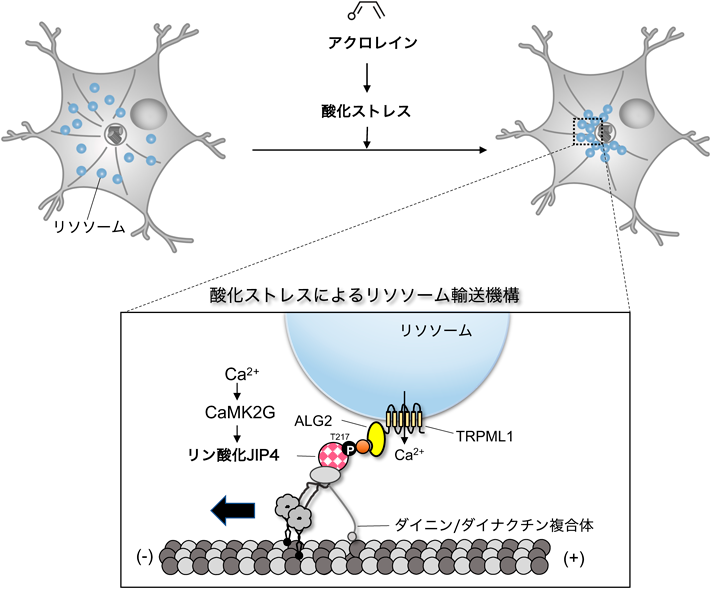
酸化ストレスに応答したリソソームの細胞内局在制御機構の解明A novel regulatory mechanism of lysosomal positioning in response to oxidative stress
1 順天堂大学大学院医学研究科老人性疾患病態・治療研究センターResearch Institute for Diseases of Old Age, Juntendo University Graduate School of Medicine ◇ 〒113–8421 東京都文京区本郷2–1–1 ◇ 2–1–1 Hongo, Bunkyo-ku, Tokyo 113–8421, Japan
2 順天堂大学大学院医学研究科神経学講座Department of Neurology, Juntendo University Graduate School of Medicine ◇ 〒113–8421 東京都文京区本郷2–1–1 ◇ 2–1–1 Hongo, Bunkyo-ku, Tokyo 113–8421, Japan
3 筑波大学医学医療系神経内科学分野Department of Neurology, Institute of Medicine, University of Tsukuba ◇ 〒305–8576 茨城県つくば市天久保2–1–1 ◇ 2–1–1 Amakubo, Tsukuba, Ibaraki 305–8676, Japan